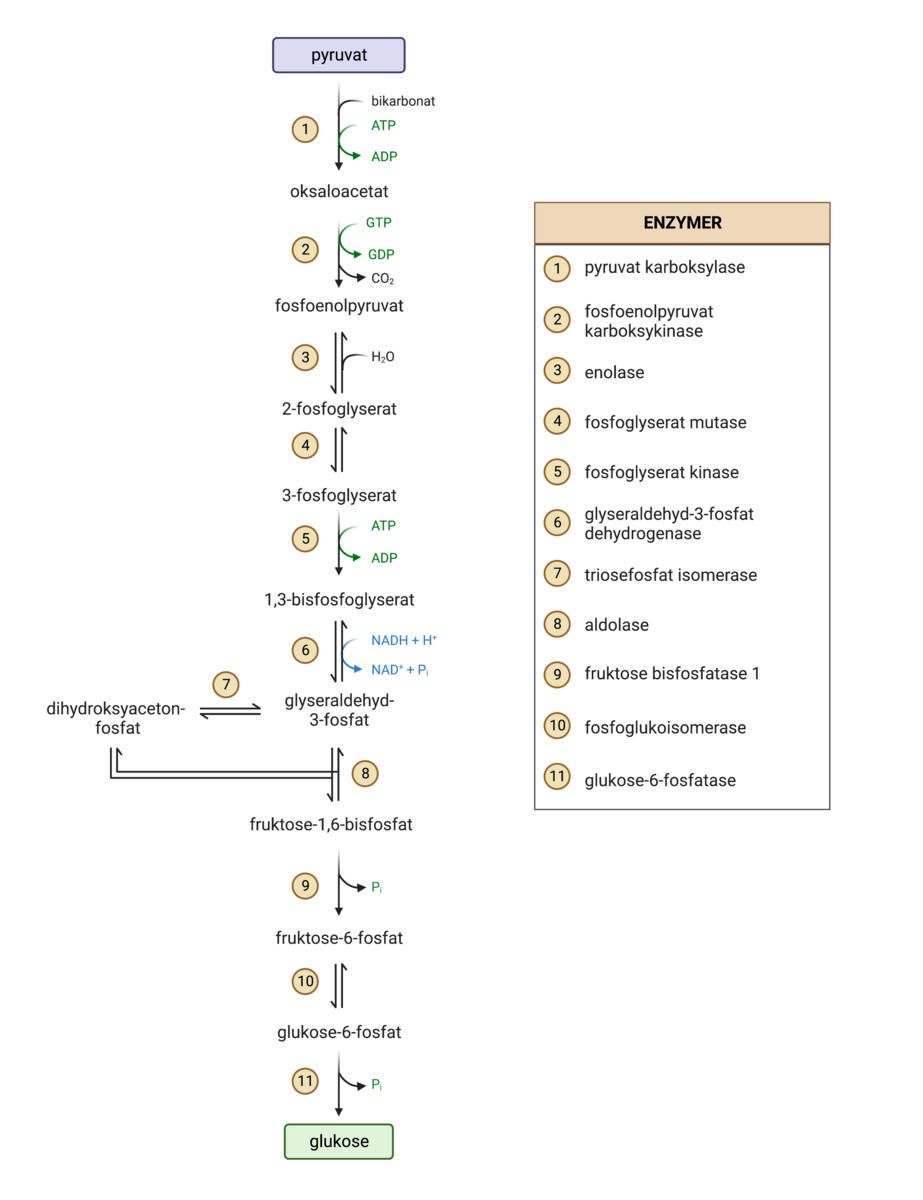
Glukoneogenesen består av elleve enzymkatalyserte reaksjoner. Syv av reaksjonene er felles med glykolyse, og katalyseres av de samme enzymene. Disse reaksjonene kalles likevektsreaksjoner, og kan gå begge veier. Hvilken retning likevektsreaksjonene går i bestemmes av flyten gjennom en reaksjonsvei.
Fire av reaksjonene i glukoneogenesen er irreversible reaksjoner, og disse katalyseres av enzymer som er særegne for glukoneogenese. De fire irreversible reaksjonene fungerer som flaskehalsreaksjoner, og aktiviteten til disse enzymene bestemmer derfor hastigheten gjennom reaksjonsveien.
Flaskehalsreaksjonene i glukoneogenesen reverserer reaksjon 1, 3 og 10 i glykolysen. De to første reaksjonene i glukoneogenesen reverserer den tiende reaksjonen i glykolysen. Reaksjon 10 i glykolysen innebærer et stort tap av iboende energi fra reaktant til produkt, og reverseringen av denne reaksjonen går derfor over to separate energikrevende reaksjoner i glukoneogenesen. Reaksjon 9 i glukoneogenesen inngår i den hormonelle samreguleringen av glukoneogenese og glykolyse. Denne reaksjonen er det viktigste reguleringspunktet i glukoneogenesen, og dikterer i stor grad flyten gjennom hele reaksjonsveien. Reaksjon 11 i glukoneogenesen reverserer reaksjon 1 i glykolysen. Denne reaksjonen produserer glukose, som kan skilles ut fra leveren og ut i blodet.
Glukoneogenesen er en reaksjonsvei som omdanner forbindelser med tre karboner til glukose, som er en forbindelse med seks karboner. Frem til tre-karbonforbindelsene dihydroksyacetonfosfat og glyseraldehyd-3-fosfat settes sammen til seks-karbonforbindelsen fruktose-1,6-bisfosfat, skjer alle reaksjonene, bortsett fra dannelsen av dihydroksyacetonfosfat, to ganger for hvert glukosemolekyl som produseres.
- Reaksjon en er den første av to reaksjoner som reverserer dannelsen av pyruvat fra fosfoenolpyruvat i glykolysen. Enzymet pyruvat karboksylase setter sammen bikarbonat og pyruvat til oksaloacetat med energi fra ett ATP-molekyl. I motsetning til de ti andre reaksjonene i glukoneogenesen skjer denne reaksjonen inne i mitokondriene. Enzymet pyruvat karboksylase aktiveres allosterisk av høye nivåer av acetyl-CoA i mitokondriene. Høye nivåer av acetyl-CoA fungerer som et signal til cellen om at det er nødvendig å produsere mer oksaloacetat. Oksaloacetat produseres for å oksidere acetyl-CoA i sitronsyresyklus, og for å eventuelt produsere ny glukose når blodsukkeret blir lavt. Ettersom resten av reaksjonene i glukoneogenesen foregår i cytosol, må oksaloacetat fraktes ut av mitokondriene. Dette gjøres ved å omdanne oksaloacetat til malat, som kan krysse mitokondriemembranen. Når malat kommer ut i cytosol blir det omdannet tilbake til oksaloacetat. Dannelsen og tilbakedannelsen av malat katalyseres av enzymet malat dehydrogenase.
- Reaksjon to er den andre reaksjonen som reverserer dannelsen av pyruvat fra fosfoenolpyruvat i glykolysen. Enzymet fosfoenolpyruvat karboksykinase spalter av karbondioksid fra oksaloacetat, og danner dermed tre-karbonforbindelsen fosfoenolpyruvat. Reaksjonen er drevet av hydrolysering av GTP til GDP.
- Reaksjon tre er en kondensasjonsreaksjon der et vannmolekyl tilsettes til karbonkjeden i fosfoenolpyruvat. Enzymet enolase danner 2-fosfoglyserat fra fosfoenolpyruvat. Kondensasjonsreaksjonen løser en dobbeltbinding mellom karbonene i karbonkjeden og plasserer en alkoholgruppe på det tredje karbonet i kjeden.
- Reaksjon fire er en isomeriseringsreaksjon der strukturen i molekylet endres. Enzymet fosfoglyserat mutase omdanner 2-fosfoglyserat til 3-fosfoglyserat ved å flytte fosfatgruppen fra karbon 2 til karbon 3.
- Reaksjon fem er en fosforyleringsreaksjon der 3-fosfoglyserat fosforyleres til 1,3-bisfosfoglyserat. Enzymet fosfoglyserat kinase legger til en ny fosfatgruppe på karbon 1 i karbonkjeden. Fosfatgruppen som brukes i reaksjonen tilføres fra hydrolyse av ATP.
- Reaksjon seks er en defosforyleringsreaksjon der fosfatgruppen på karbon 1 i 1,3-bisfsfoglyserat-molekylet erstattes med et hydrogenatom. Enzymet glyseraldehyd-3-fosfat dehydrogenase bruker energi fra oksidasjon av NADH til å spalte av og erstatte fosfatgruppen på karbon 1 med et hydrogen, og danner glyseraldehyd-3-fosfat.
- Reaksjon syv er en isomeriseringsreaksjon der halvparten av glyseraldehyd-3-fosfat-molekylene som dannes i reaksjon seks blir omdannet til isomeren dihydroksyacetonfosfat. Omdannelsen legger grunnlaget det neste reaksjonssteget, hvor de to tre-karbonforbindelsene dihydroksyacetonfosfat og glyseraldehyd-3-fosfat settes sammen til seks-karbonforbindelsen froktose-1,6-bisfosfat. Reaksjonen katalyseres av enzymet triosefosfat isomerase, som over to steg flytter en dobbeltbinding mellom karbon og oksygen fra karbon en til karbon to.
- Reaksjon åtte danner fruktose-1,6-bisfosfat fra dihydroksyacetonfosfat og glyseraldehyd-3-fosfat. Enzymet aldolase setter sammen de to tre-karbonforbindelsene på karbonene som har oksygenatomer bundet til seg med dobbeltbindinger. Dette danner seks-karbonforbindelsen fruktose-1,6-bisfosfat
- Reaksjon ni er det viktigste reguleringspunktet i glukoneogenesen, og inngår i den hormonelle samreguleringen av glykolyse og glukoneogenese. Reaksjon ni er den tredje av de fire reaksjonene som er unike for glukoneogenesen. Enzymet fruktose bisfosfatase 1 omdanner fruktose-1,6-bisfosfat til fruktose-6-fosfat. Omdannelsen foregår ved at fruktose bisfosfatase 1 bruker et vannmolekyl til å hydrolysere og spalte av fosfatgruppen på karbon 1 på fruktosemolekylet, slik at det dannes fruktose-6-fosfat og inorganisk fosfat.
- Reaksjon ti er en isomeriseringsreaksjon der enzymet fosfoglukoisomerase omdanner fruktose-6-fosfat til glukose-6-fosfat. Omdannelsen foregår ved at enzymet flytter bindingen til bro-oksygenet i ringstrukturen fra karbon to til karbon en. Dette endrer ringstrukturen fra en femkant (fruktose) til en sekskant (glukose)
- Reaksjon elleve er den siste av de fire reaksjonene som er unike for glukoneogenesen. Reaksjonen reverserer den første reaksjonen i glykolysen, som gjennom fosforylering binder glukose til metabolisering i cellen. Reaksjonen katalyseres av enzymet glukose-6-fosfatase, og likner reaksjon ni. Glukose-6-fosfatase bruker også et vannmolekyl, og hydrolyserer og spalter av den siste fosfatgruppen slik at det dannes glukose og inorganisk fosfat. Glukosen som produseres i denne reaksjonen kan sendes ut av leveren og forsyne andre vev med energi.




Kommentarer (2)
skrev Øyvind Roth
Det står:
"...Glukoneogenesen foregår hovedsakelig i leverceller, men også noe i celler i nyrebarken. ..."
Er det riktig? Skal det stå "binyrebarken" og ikke "nyrebarken"?
svarte Øyvind Roth
Beklager, leste feil.
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.