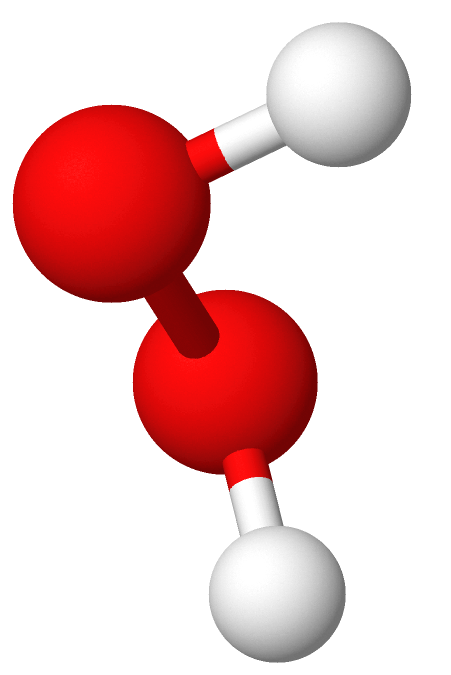
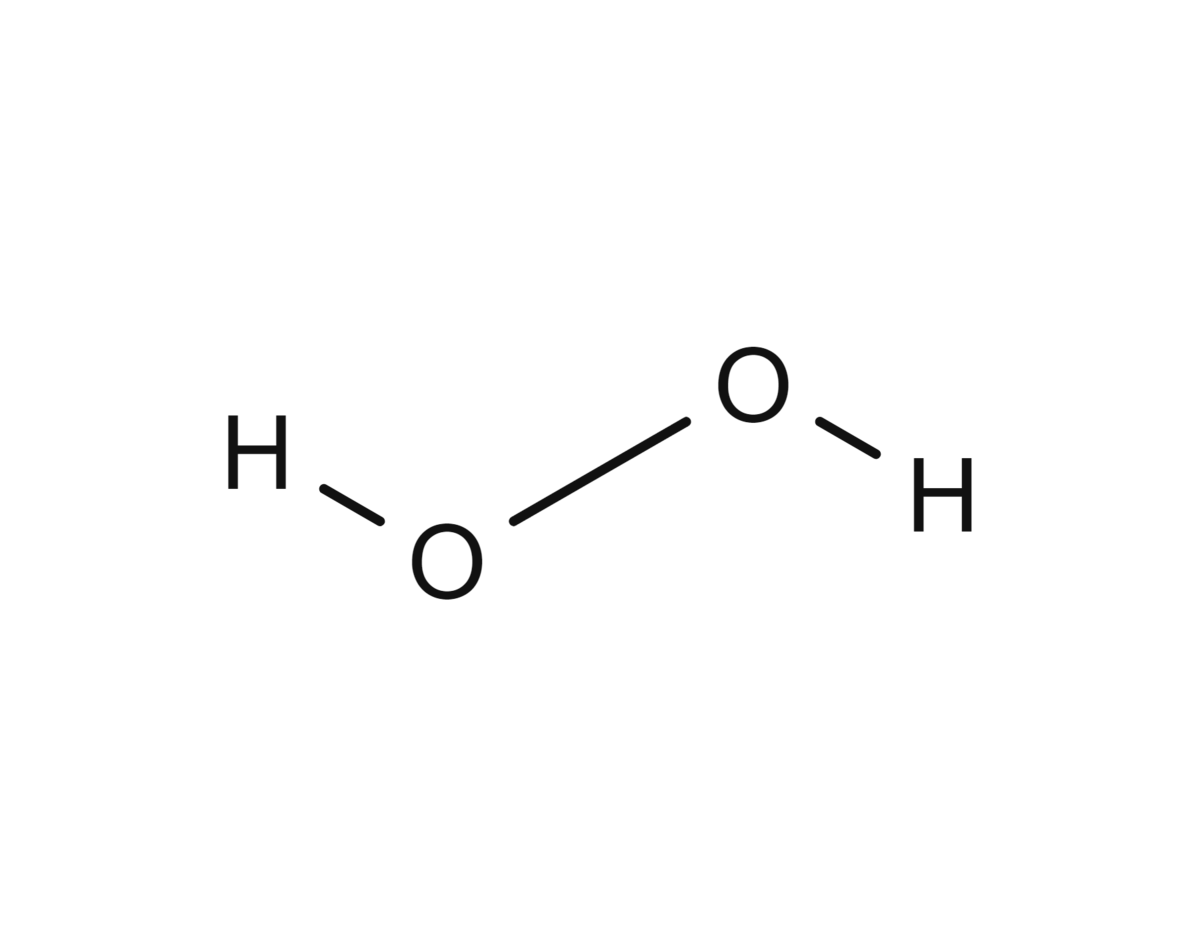
Hydrogenperoksid er en fargeløs kjemisk forbindelse av hydrogen og oksygen. I helt ren form er hydrogenperoksid en tyktflytende væske som er uhyre eksplosiv. Det er også et sterkt oksidasjonsmiddel, og brukes derfor blant annet som blekemiddel.
Faktaboks
- Uttale
- hydrogˈenperoksid
Hydrogenperoksid har den kjemiske formelen H2O2, det vil si at molekylet består av to hydrogenatomer og to oksygenatomer, til forskjell fra vanlig vann, som kun har ett oksygenatom (H2O). Hydrogenperoksid avgir lett det ene oksygenatomet.
Stoffet er tilgjengelig på apotek som en vannløsning med 3 prosent hydrogenperoksid. Det finnes mer konsentrerte løsninger, men disse bør behandles med stor forsiktighet, da hydrogenperoksid virker kraftig etsende på huden.






Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.