Er ionet positivt ladet, kalles det et kation. Er det negativt ladet, kalles det et anion.
Ioner kan ha mer enn en elementærladning. I kationer er det færre elektroner enn kjerneladninger, mens det i anioner er flere elektroner enn kjerneladninger.

Er ionet positivt ladet, kalles det et kation. Er det negativt ladet, kalles det et anion.
Ioner kan ha mer enn en elementærladning. I kationer er det færre elektroner enn kjerneladninger, mens det i anioner er flere elektroner enn kjerneladninger.
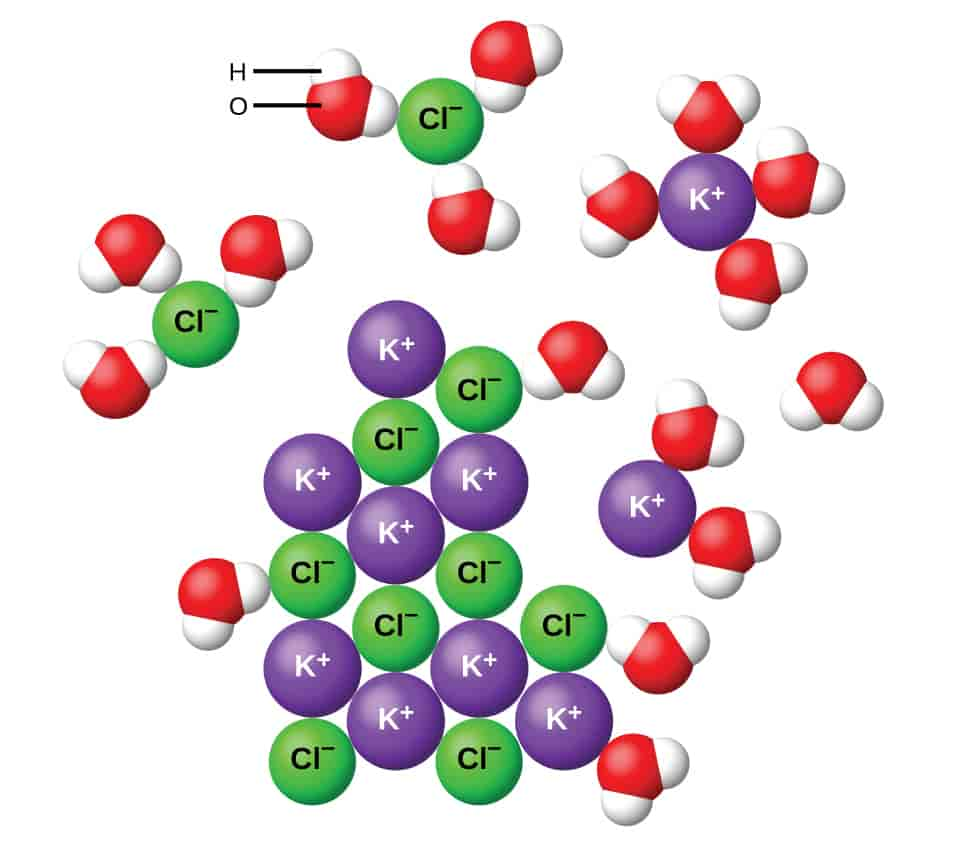
Når et salt løses opp i vann, frigjøres det ioner i løsningen. Det kalles dissosiasjon. Vanlig bordsalt, natriumklorid, danner natriumioner (Na+) og kloridioner (Cl–) når det løses i vann. Na+ er da kationer, mens Cl- er anioner.
Dersom en slik saltløsning plasseres i et elektrisk felt, som ved elektrolyse, vil de positivt ladete natriumionene (kationer) vandre mot den negative elektroden (katoden), mens de negativt ladde kloridionene (anioner) vil vandre mot den positive elektroden (anoden). Det er denne vandringen som har gitt opphavet til begrepet ion.
En rekke kjemiske forbindelser som syrer, baser og salter, dissosierer til ioner i vann. Natriumklorid dissosierer fullstendig. Andre stoffer, for eksempel eddiksyre, blir bare i liten grad dissosiert. Rent vann (H2O) er meget svakt dissosiert i hydrogenioner (H+) og hydroksylioner (OH–).
I et saltgitter vil kationer og anioner vekselvirke gjennom elektrostatiske krefter og være plassert regelmessig i forhold hverandre. Det fører til at ladningene totalt sett utligner hverandre på makroskopisk nivå, og en saltkrystall er dermed elektrisk nøytral.
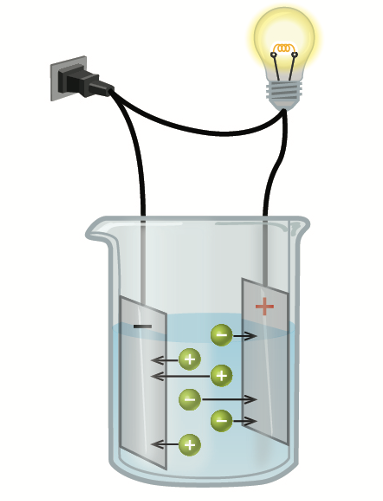
Ved elektrolyse av en løsning av natriumklorid vil det skje reduksjon ved katoden og oksidasjon ved anoden:
\(\ce{Na+ + e^{-} -> Na}\)
\(\ce{2Cl^{-} -> Cl2 + 2 e^{-}}\)
Denne typen reaksjoner der elektroner (e–) inngår i reaksjonsligningen, såkalte halvreaksjoner, danner grunnlaget for spenningsrekka som står sentralt i elektrokjemien. Utvikling av batteriteknologi alltid har vært et viktig forskningsområde innen elektrokjemi. I dag arbeides det mye med å finne frem til forbedrete batterityper, som litiumionebatterier og natriumionebatterier.
Frie kationer i gassfasen dannes ved å tilføre nøytrale forbindelser tilstrekkelig energi til at ett eller flere elektroner frigjøres. Energien tilføres da ved bomardement med energirike elektroner eller gjennom lys med tilstrekkelig kort bølgelengde. Frie anioner dannes på lignende vis, men krever mindre energi. Noen molekyler og atomer har til og med den egenskapen at de danner anioner ved spontant å fange opp langsomme elektroner.
Ved å analysere i hvilken grad frie ioner i et vakumkammer avbøyes i elektriske eller magnetiske felt, er det mulig å måle massen av ionene. Dette prinsippet utnyttes innen massespektrometri, som er en viktig metode for både kvalitativ og kvantitativ kjemisk analyse. En finner ellers frie ioner i for eksempel flammer, lysrør og i den ytre atmosfære (ionosfæren).
Ioner spiller en stor rolle i fysiologiske prosesser i alle levende vesener. En riktig balanse mellom mengden av essensielle ioner som Na+, K+og Cl– er helt nødvendig for å opprettholde livsprosessene. Proteiner bærer mange elektriske ladninger, både positive og negative, men de fleste har et overskudd av negative ladninger under fysiologiske forhold (pH nær 7). Transport av ioner skjer gjennom egne ionekanaler som åpnes og stenges etter behov, styrt av cellenes signalsystemer.
Grunnlaget for elektrokjemien ble lagt av Luigi Galvani og Allesandro Volta helt på slutten av 1700-tallet, og Volta konstruerte da det første batteriet. Michael Faraday innførte begrepet 'ion' i 1834 da han studerte elektrolyse (også et begrep innført av Faraday). Dissosiasjonsteorien stammer fra Svante Arrhenius som forklarte den i en avhandling fra 1884.

Kommentarer (2)
skrev Jakob Breyholtz
Hei, hvordan blir et ion dannet?
svarte Anne Eilertsen
Hei! Ioner dannes når syrer, baser og salter blir løst opp i vann eller et annet løsemiddel (dissosiasjon). De kan også for eksempel dannes på grunn av ioniserende stråling, som vi har egen artikkel om: https://snl.no/ioniserende_str%C3%A5ling
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.