De enkleste kjente polymorfismene på DNA-nivå består av en variasjon i et enkelt nukleotid (G, A, T eller C) i DNA og kalles SNP (forkortelsen står for single nucleotide polymorfism, og uttales gjerne «snipp»). De kan påvises ved de samme metodene som andre varianter i genene, for eksempel direkte sekvensering.
Mange SNP-er er nøytrale, som betyr at de ikke har noen merkbar effekt på genotypen. En nøytral variant i et ekson kan også være «silent» (stille), som betyr at den ikke gir noen endring av genproduktet.
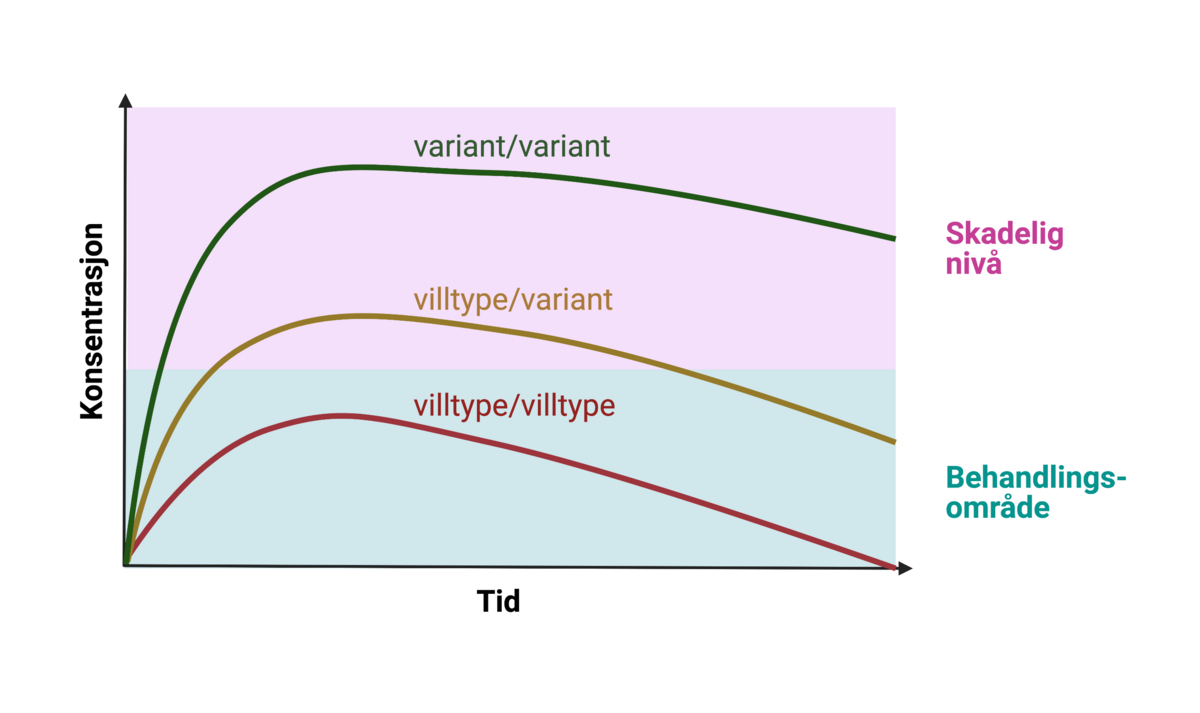
Mange genetiske polymorfismer har ikke noen særlig betydning for sykdom og helse, i alle fall ikke alene. Polymorfismene som er mest til nytte i medisinsk praksis er kanskje de farmakogenetiske variantene. Det vil si hyppige genetiske varianter som kan forklare individuelle forskjeller i virkningen (farmakodynamikk) eller nedbrytningen (farmakokinetikk) av et legemiddel. Pasienter med en farmakogenetisk variant som gir langsom nedbrytning av et stoff kan få for høye konsentrasjoner av stoffet i blodet, som kan være skadelig. Pasienter med en variant som gir for rask nedbrytning, kan få for lite. I begge tilfeller kan det bli nødvendig å justere dosen. For noen medikamenter er det vanlig å sjekke konsentrasjonen i blodprøve hos pasienten før det eventuelt gjøres en farmakogenetisk undersøkelse.
En SNP som kan ha betydning som risikofaktor for blodpropp, er en variant i genet FV, som koder for faktor 5 i blodets levringsprosess (koagulasjon). En kjent polymorfisme i genet ble identifisert i den nederlandske byen Leiden, og er etter det blitt kalt faktor 5 Leiden-mutasjonen. Da blodpropp er en multifaktoriell tilstand, er det imidlertid ikke tilstrekkelig å ha en slik variant for å iverksette medisinske tiltak. Først hvis det har forekommet blodpropp i slekten, kan bærertilstand for en variant være avgjørende for forebyggende tiltak hos slektningene. To varianter (homozygositet) gir imidlertid betydelig økt risiko for blodpropp, men forekommer sjelden.
Det har lenge vært kjent at et enzym (metylentetrahydrofolat reduktase, MTHFR) som trengs for omsetningen av B-vitaminet folat i kroppen finnes i to ulike varianter, der den ene er mer følsom enn den andre for varme i laboratoriet. Forklaringen ble funnet å være en SNP i genet som koder for enzymet MTHFR. Da det på 1990-tallet ble oppdaget at tilskudd av folat til kvinner i tiden rundt befruktningen kunne forebygge medfødte misdannelser hos fosteret, ble det mistenkt at personer med den varmepåvirkelige varianten av MTHFR kunne ha høyere risiko for ryggmargsbrokk, og at dette kunne forklare effekten av vitamintilskuddet. Mange år senere er det blitt forsket på tusenvis personer for å undersøke denne hypotesen, men det ser ikke ut til at bærere av SNP-en har statistisk signifikant høyere risiko. Anbefalingen om folattilskudd gjelder naturligvis fortsatt, selv om mekanismen ikke er kjent.
Omfattende gentester som omfatter mange polymorfismer tilbys av en rekke kommersielle aktører, selv om utsagnskraften for sykdom og nytten av testene er svært liten.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.