Kreftbehandling er behandling av kreft med for eksempel kirurgi, strålebehandling, cellegiftbehandling eller immunterapi. Behandlingen varierer fra pasient til pasient og fra kreftform til kreftform. Ofte behandles kreftpasienter med en kombinasjon av ulike metoder.
kreftbehandling
Behandlingsstrategier
Kurativ og palliativ behandling
Kreftbehandling pågår ofte over lang tid, gjerne over flere år. Når diagnosen er stilt og det videre forløpet skal planlegges, må det tas stilling til hva som skal være formålet med behandlingen. I læren om kreftsykdommer (onkologi) skiller man mellom kurativ og palliativ behandling. Kurativ behandling har som mål å kurere pasienten, altså at vedkommende skal bli kreftfri. Palliativ (lindrende) behandling har ikke som mål å kurere kreftsykdommen, men tar sikte på at pasienten skal ha færrest mulig plager og smerter, både fra kreftsykdommen og fra bivirkninger av behandlingen. Eventuelle langsiktige bivirkninger er mindre viktige ved palliativ behandling, ettersom pasientene har kort forventet levetid.
Formålet med behandlingen kan forandre seg underveis. En pasient som har mottatt eller mottar kurativ behandling kan for eksempel få tilbakefall eller spredning av kreftsykdommen. Da kan det være at formålet med behandlingen endres og man i stedet har som mål å gi best mulig lindrende behandling.
Adjuvant behandling
Selv om man har operert bort hele svulsten, kan det være kreftceller igjen i kroppen, uten at de gir symptomer eller synes på MR eller CT. Adjuvant behandling har som formål å angripe disse resterende kreftcellene og dermed redusere risikoen for tilbakefall. Det kan dreie seg om hormonbehandling, cellegift, strålebehandling eller ulike kombinasjoner av disse. Et eksempel på adjuvant behandling er antiøstrogen (tamoxifen) til brystkreftpasienter hvor det er påvist østrogenreseptorer i svulsten.
Neoadjuvant behandling
Neoadjuvant behandling går ut på å redusere størrelsen på kreftsvulsten eller fjerne mikroskopiske metastaser før svulsten skal fjernes kirurgisk. Dette behandlingsprinsippet brukes for eksempel ved kreft i magesekken (ventrikkelkreft) og ved flere former for barnekreft.
Vurdering av behandlingseffekt
Underveis i behandlingsforløpet vurderer man effekten av behandlingen. Dette kan gjøres på flere ulike måter. Bildediagnostikk, for eksempel CT eller MR-undersøkelse, brukes for å kartlegge størrelsen og utbredelsen av svulsten og eventuell spredning (metastaser). For visse kreftformer kan også tumormarkører i blodet gi viktig informasjon om behandlingseffekt, for eksempel PSA ved prostatakreft.
Oppfølging
Underveis og etter gjennomgått behandling, følges kreftpasienter opp av helsevesenet. Formålet er å kunne oppdage tilbakefall (residiv) eller spredning på et tidlig stadium, og å kunne redusere eventuelle bivirkninger av kreftbehandlingen. For mange kreftformer er det slik at man følges opp i fem år etter fullført behandling, ettersom man vet at sjansen for tilbakefall er lavere når man har vært kreftfri i fem år. Noen følges også enda lenger, for eksempel brystkreftpasienter, som gjerne følges i ti år etter fullført behandling.
Kirurgi
Moderne kreftkirurgi er en av flere bestanddeler i et tverrfaglig behandlingsregime. Man har gått bort fra idéen om å fjerne mest mulig (radikale operasjoner). I dag er målet snarere å bevare form, funksjon og livskvalitet for pasienten i størst mulig grad, samtidig som overlevelsen er så god som mulig. Rekonstruksjon og transplantasjon er blitt viktige deler av kreftkirurgien.
Komplikasjonene og dødeligheten etter kreftkirurgi har sunket drastisk for mange kreftformer. Med bildediagnostiske teknikker som CT og MR kan kirurgene planlegge operasjonen på en god måte. Kikkhullskirurgi har blitt en vanlig teknikk og er forbundet med færre komplikasjoner etter operasjonen.
- Les mer om kreftkirurgi.
Strålebehandling
Ved strålebehandling prøver man å ødelegge kreftcellene med minst mulig skade på den friske kroppen rundt. Strålebehandling har gjennomgått en omfattende teknologisk utvikling, og vi har nå fått svært energirike strålemaskiner, metoder for nøyaktig lokalisering og beregning av de stråledoser som skal dekke svulst og risikoområder, samt dypere forståelse av hvordan slike stråler virker. Dette har revolusjonert strålebehandling av flere kreftformer. Noen svulstformer kan helbredes ved strålebehandling, for eksempel prostatakreft, visse former for hudkreft, kreft på stemmebåndene og i livmorhalsen, samt enkelte former av kreft i lymfeknutene (lymfom).
Stråling er et viktig tillegg til kirurgi ved enkelte stadier av brystkreft og endetarmskreft. Strålebehandling kan også gis som innvendig bestråling fra radioaktive stoffer som tilføres pasienten. Dette kalles brachyterapi.
- Les mer om strålebehandling.
Cellegift
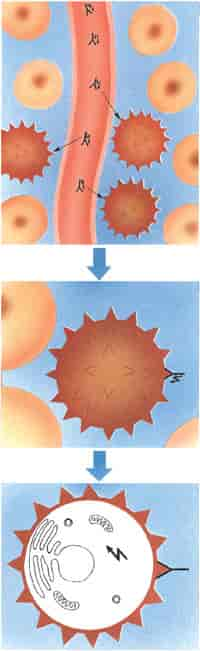
Kreft. Skjematisk fremstilling av prinsippene for målsøkende kreftbehandling med kjemiske stoffer - behandling med cellegift: De runde cellene med kjerne er friske, de taggete er kreftceller. På den øverste tegningen føres cellegiften (markert omvendt Y pluss lyn) med blodstrømmen, trenger gjennom åreveggen og tar seg frem til de syke cellene. I midten fester det målsøkende elementet (Y) seg til kreftcellen, hvor giften (lynet) deretter frigjøres og går til angrep på den syke cellen (nederst).
Cellegift, også kalt cytostatika, er en type legemidler som brukes i behandling av mange typer kreft. Som oftest behandles pasienten med en kombinasjon av ulike typer cellegift som har ulike virkningsmekanismer.
Cellegift brukes blant annet i behandling av blodkreft (leukemi), lymfom, en ondartet svulst som utgår fra morkaken (choriokarsinom) og testikkelkreft. Mange av disse pasientene kan helbredes med cellegiftbehandling. Testikkelkreft er et eksempel på en kreftform hvor cellegift er spesielt effektivt. Tidligere døde ni av ti pasienter med testikkelkreft med spredning. Etter at cisplatinbehandling ble innført, blir imidlertid 95 prosent av pasientene friske.
Cellegift kan også gis som tilleggsbehandling til kirurgi ved for eksempel brystkreft eller tykktarmskreft. Hensikten er da å redusere risikoen for tilbakefall, og slik behandling kalles adjuvant kjemoterapi.
- Les mer om behandling med cellegift.
Hormonbehandling
Hormonbehandling brukes ved kreft i organer som enten selv produserer hormoner eller er påvirket av dem. For eksempel behandles prostatakreft og brystkreft ofte med hormoner.
Hormonbehandling av kreft kan lindre symptomer og gi økt livskvalitet, men kan ofte også gi bivirkninger, som for eksempel nedsatt seksuell lyst, ereksjonsproblemer, hetetokter, beinskjørhet, humørsvingninger og nedstemthet. Valget av behandlingen blir derfor en nøye avveining mellom gevinsten og de bivirkningene som pasienten opplever.
- Les mer om hormonbehandling av kreft.
Målrettet kreftbehandling
Målrettet kreftbehandling vil si at man bruker legemidler som er rettet direkte mot molekylære mekanismer eller signalveier som er viktige i kreftcellene. Den grunnleggende tanken er at legemidlene effektivt skal kunne hemme eller drepe kreftcellene, fordi disse er spesielt avhengige av bestemte molekyler for å kunne vokse og dele seg. Samtidig skal en slik behandling medføre færre alvorlige bivirkninger enn hva strålebehandling og cellegift gjør, fordi normale celler har andre molekylære reguleringsmekanismer og dermed rammes i mindre grad.
Det finnes i dag mange ulike typer målrettede kreftbehandling som angriper én eller flere signalveier. Det vanligste er at disse brukes sammen med andre former for kreftbehandling, for eksempel stråling eller cellegift. I tillegg er en lang rekke målrettede kreftbehandlingslegemidler under klinisk utprøving. De to vanligste formene er monoklonale antistoffer og tyrosinkinasehemmere.
- Les mer om målrettet kreftbehandling.
Immunterapi
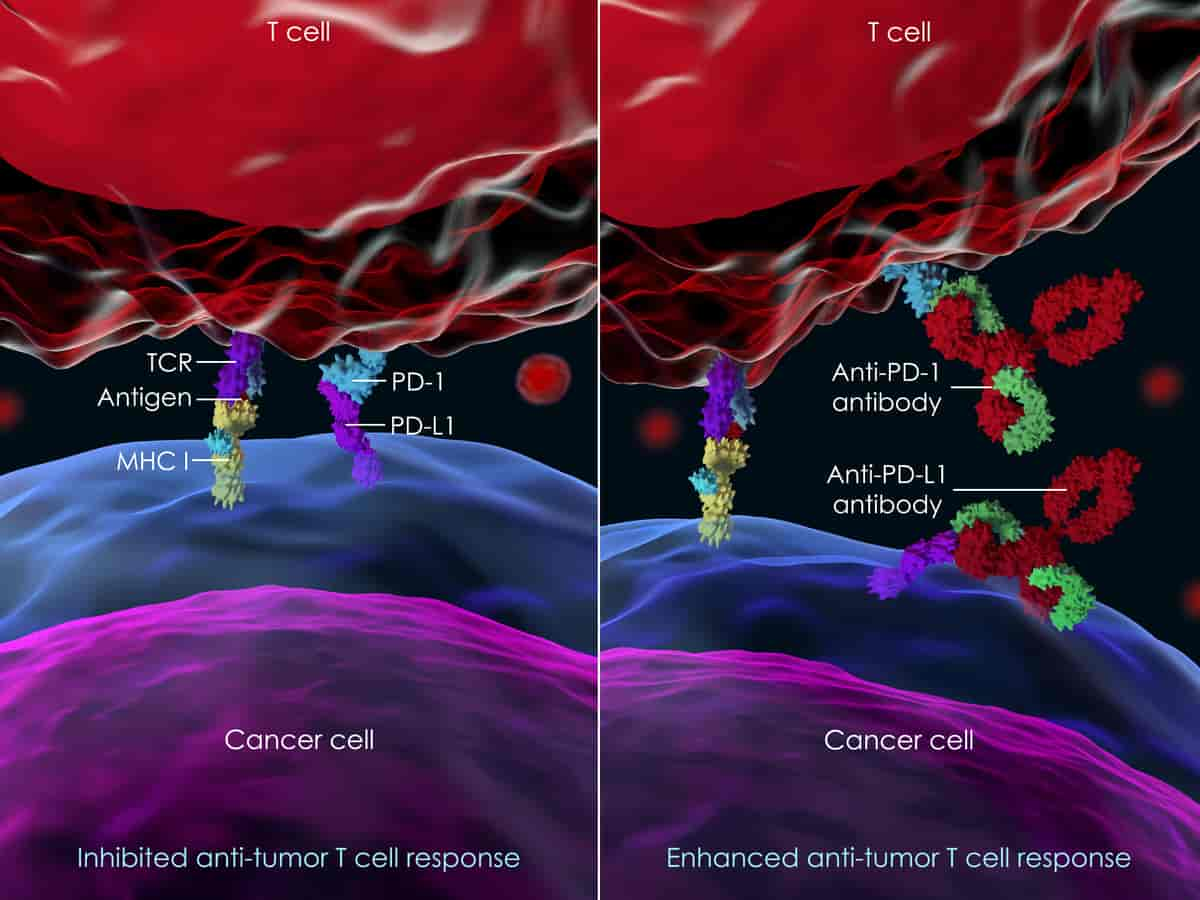
Immunterapi med sjekkpunkthemmere. Bildet viser en immuncelle (rød) som uttrykker reseptoren PD-1, og en kreftcelle (lilla) som uttrykker liganden PD-L1. I bildet til venstre er PD-1 bundet til PD-L1. Denne bindingen hindrer T-cellen i å angripe kreftcellen. Bildet til høyre viser den samme situasjonen når pasienten behandles med sjekkpunkthemmere. Monoklonale antistoffer rettet mot enten PD-1 eller PD-L1 hindrer bindingen mellom de to molekylene. Dermed faller den hemmende effekten av PD-1 bort, og T-cellen kan angripe kreftcellen.
Immunterapi som kreftbehandling vil si at man utnytter kroppens eget immunsystem i bekjempelsen av kreftsykdommen. Immunterapi fikk sitt gjennombrudd i kreftbehandling i 2010. De to metodene som har kommet lengst, er såkalte sjekkpunkthemmere (engelsk checkpoint inhibitors) og T-celler med kimære antigenreseptorer (engelsk «CAR-T cells»).
- Les mer om immunterapi.
Prognose
Resultatene av moderne kreftbehandling er svært ulike, avhengig av kreftformen og dens utbredelse. Over 75 prosent av samtlige norske kreftpasienter lever 5 år etter kreftdiagnosen (tall fra 2021), sammenlignet med samme aldersgruppe uten kreftsykdom. Resultatene er ofte gunstigere for kvinner enn for menn. Noen kreftformer som i prinsippet er lette å forebygge, for eksempel lungekreft, hører til den gruppen hvor behandlingsresultatene er dårlige.
Behandlingen har imidlertid også stor verdi når det gjelder å lindre smerter og undertrykke symptomer. For svært mange kreftpasienter gjelder det at selv om de ikke kan helbredes, kan moderne behandling gi pasienten lengre levetid, med mindre plager og langt bedre livskvalitet enn tidligere.
Kreftbehandling er et felt hvor alternative behandling ofte kommer med forslag om bruk av nye metoder, planteekstrakter, bruk av vitaminer i høye doser og så videre. Generelt kan det sies at praktisk talt alle slike alternative behandlingsforsøk har vist seg uvirksomme. Enkelte slike ekstrakter kan til og med inneholde kreftfrembringende eller andre giftige stoffer, eller negativt påvirke effekten av vanlig kreftmedisin. Kreftbehandling bør foregå med vitenskapelig anerkjente behandlingsformer. Flere hundre tusen planteekstrakter og andre naturprodukter er testet vitenskapelig mot kreft. 10–15 av de mest brukte cellegiftene er renfremstilte naturprodukter som har blitt grundig testet.
Kreft er en folkesykdom i Norge, og store deler av forskningens og helsevesenets ressurser brukes på dette feltet. Det offentlige helsevesenet finansierer det meste av gjør den største innsats, men betydelige bidrag kommer også fra Kreftforeningen, med dens tilsluttede underavdelinger. Forebygging og tidlig behandling er de viktigste faktorene når det gjelder å redusere forekomsten av kreft. Her kan hvert menneske gjøre sitt ved å endre livsvaner, og ved å reagere på tidlige symptomer på kreft.



Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.