Nitrater er en fellesbetegnelse for kjemiske forbindelser som er salter eller estere av salpetersyre (som har kjemisk formel HNO3). De brukes blant annet i legemidler og sprengstoff.
Saltene fremstilles ved å løse metaller, metalloksider, metallhydroksider eller metallkarbonater i salpetersyre. Natrium-, kalium-, ammonium- og kalsiumnitrat er teknisk viktige nitrater. Kaliumnitrat kalles også salpeter.
Ved oppvarming spaltes de tunge metallenes nitrater i metalloksid, eventuelt metall, nitrogendioksid, NO2, og oksygen. Avspaltningen av oksygen gjør at nitrater virker oksiderende ved høye temperaturer. Løst i vann virker nitrater bare oksiderende overfor sterke reduksjonsmidler.
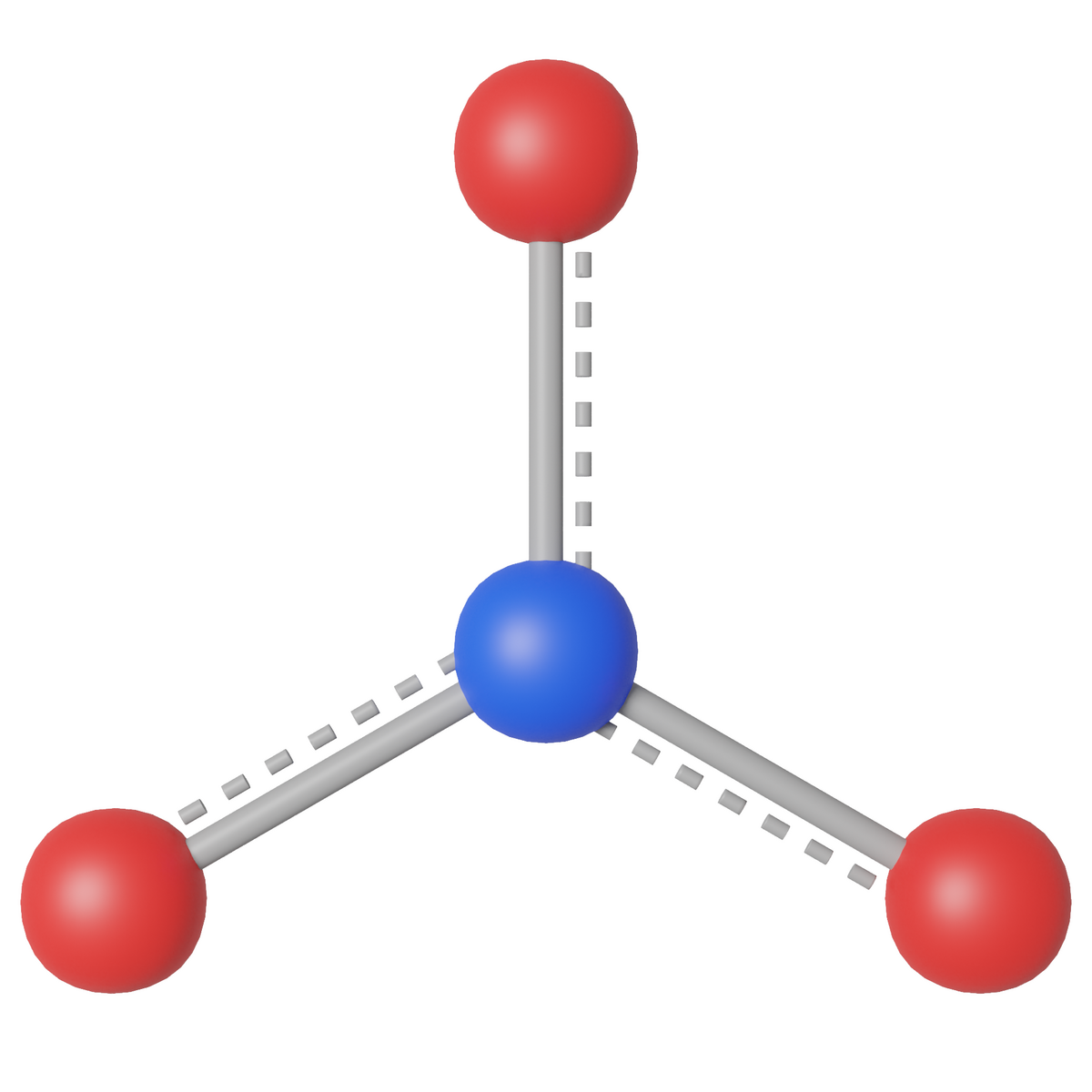
Nitrater er forbindelser som inneholder nitrat-ionet, NO3–, som er plant og isoelektronisk med karbonationet. Nitrationet har et nitrogenatom bundet til tre ulike oksygenatomer. Med tradisjonelle bindinger vil det bli dobbeltbinding mellom ett av O-atomene og N-atomet, og enkeltbinding mellom N-atomet og hvert av de to andre O-atomene. Dette er ikke mulig uten at N-atomet får plussladning og de to O-atomene bundet med enkeltbinding får hver sin minusladning. Naturen viser oss at dette ikke stemmer, det er like bindinger mellom N-atomet og hvert av de tre O-atomene, og alle O-atomene har lik ladning. Dette omtales som resonans (resonanshybridisering), at bindingene i nitrationet «flyter ut» og blir en slags «en-og-en-tredjedels-binding» og det blir 1/3-dels ladning på hvert O-atom, mens N-atomet får en full plussladning. Det er dette som er vist i figuren; det er like bindinger mellom N-atomet i midten og hvert av O-atomene.
Salpetersyrens estere har generell formel R–O–NO2, hvor R er ei metylgruppe (CH3–) eller en lengre karbonkjede, en alkylrest. Disse forbindelsene kalles nitroforbindelser i organisk kjemi.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.