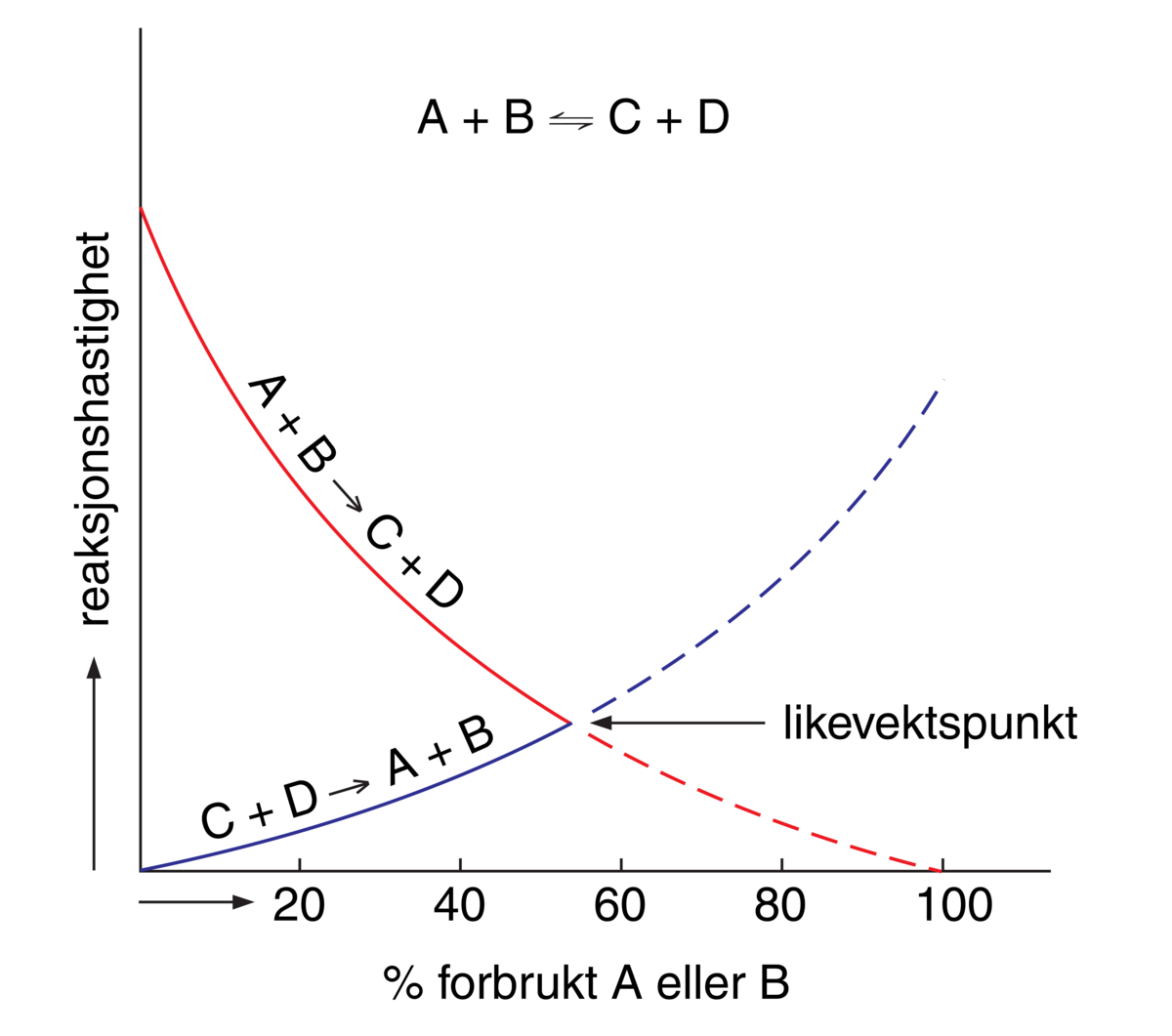
Massevirkningsloven er en beskrivelse av hvordan farten av en kjemisk likevektsreaksjon påvirkes av konsentrasjonen av de stoffene som inngår i reaksjonen (substrater og produkter). Massevirkningsloven sier at reaksjonsfarten er proporsjonal med produktet av konsentrasjonene av de reagerende stoffer.
Faktaboks
- Også kjent som
-
Guldberg og Waages lov
En kjemisk reaksjon mellom to stoffer A og B, som fører til dannelse av produktene C og D, kan skrives A + B = C + D. Ifølge massevirkningsloven vil det i enhver slik reaksjon innstille seg en likevekt der [A] × [B] = K × [C] × [D]. K kalles likevektskonstanten og er karakteristisk for denne spesielle kjemiske reaksjonen. [A], [B], [C] og [D] er den molare konsentrasjonen av de fire stoffene, oppgitt i mol per liter.
I biologi og medisin har massevirkningsloven fått betydning for forståelsen av metabolske prosesser og dissosiasjon av molekyler samt for forståelsen av interaksjonen mellom signalmolekyler i videste forstand, for eksempel hormoner og legemidler, og deres spesifikke reseptorer.







Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.