Trypsin er et viktig enzym i fordøyelsen som spalter proteiner i tynntarmen til polypeptidkjeder, som er kortere kjeder av aminosyrer. Trypsin blir skilt ut av bukspyttkjertelen og aktiveres i tolvfingertarmen. Når trypsin har utfylt sin funksjon vil enzymet deaktiveres. Mangel på det deaktiverende stoffet er en arvelig sykdom som kan medføre kronisk leversykdom og kols.
trypsin
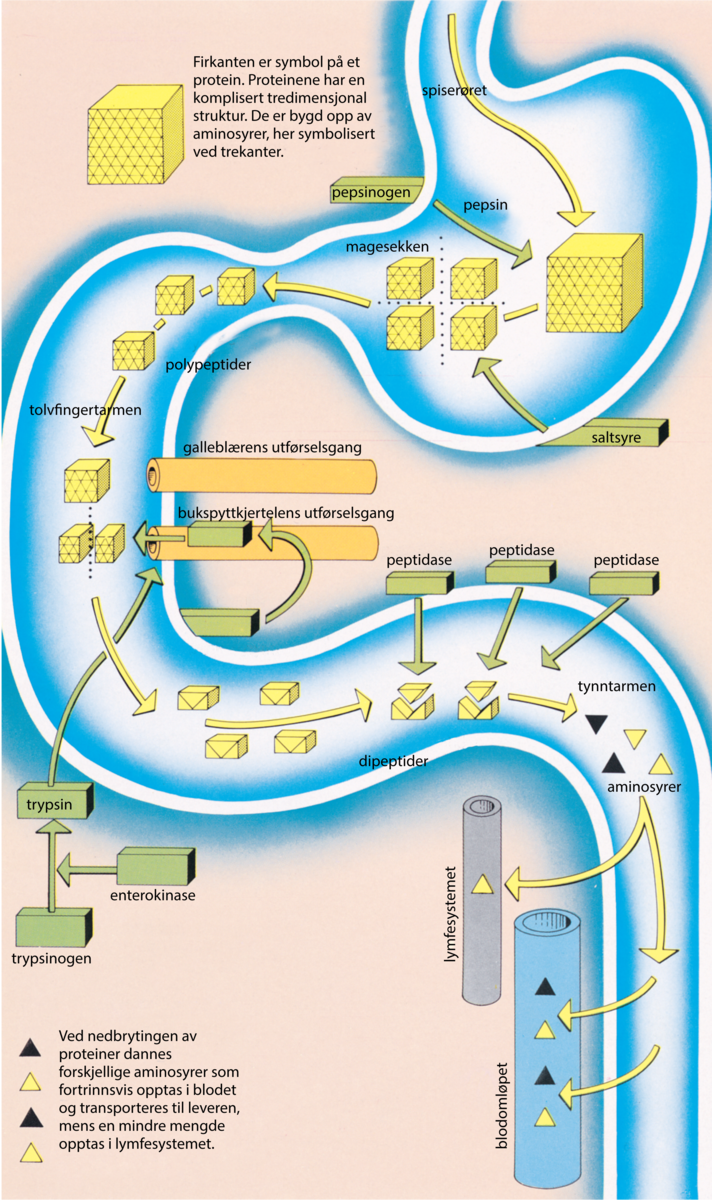
Proteinfordøyelsen. Nedbrytingen av proteiner er meget komplisert og krever at et stort antall enzymer virker sammen. Den begynner i magesekken. Kjertlene i magesekken skiller ut et stoff, pepsinogen, som først i den sure magesaften omdannes til enzymet pepsin. Pepsinet bryter ned de store proteinmolekylene til mindre molekyler, polypeptider. Nedbrytningen fortsetter i tolvfingertarmen. Cellene i tolvfingertarmen avgir hormonene sekretin og pankreozymin, som via blodet stimulerer bukspyttkjertelen til å skille ut forskjellige enzymforstadier i tolvfingertarmen. Et av disse forstadiene, trypsinogen, omdannes av et enzym i tarmsaften, enterokinase, til enzymet trypsin som angriper polypeptider og også omdanner andre enzymforstadier fra bukspyttkjertelen til virksomme enzymer. Ved den fortsatte nedbrytingen av peptider til aminosyrer som kan suges opp, medvirker tallrike enzymer. Disse kalles med et fellesnavn peptidaser.
Funksjon
Trypsin blir skilt ut som den inaktive formen trypsinogen fra bukspyttkjertelen, og blir omgjort til den aktive formen via et enzym som kalles enteropeptidase. Små mengder trypsin vil aktivere andre trypsinogen-molekyler til å danne mer trypsin. For å unngå oppsamling av trypsin som kan skade vev, skiller bukspyttkjertelen ut protease-inhibitorer som hemmer trypsin. Trypsin blir selv fordøyd i tynntarmen.
Trypsin er et sekvensspesifikt enzym som betyr at det spalter (kløyver) peptidbindingene mellom aminosyrene lysin og arginin i det lengre molekylet trypsinogen. Fordi peptidbindingene blir kløyvet innenfra i proteinkjeden, regnes trypsin som en endopeptidase. Trypsin katalyserer kløyvingen av trypsinogen via hydrolyse, en reaksjon der peptidbindingen blir spaltet i to ved innvirkning av vann. Den katalytiske triaden i det aktive setet til trypsin består av aminosyrene serin, histidin og asprartat.
Når det ikke behøves mer trypsin, skiller bukspyttkjertelen ut protease-inhibitorer som for eksempel alfa1-antitrypsin som hemmer trypsin. Mangel på alfa1-antitrypsin er en arvelig sykdom og kan medføre kronisk leversykdom og eller kronisk lungesykdom (kols) på grunn av økt bindevevsdannelse.
Aktivering av trypsin
Når mat passerer gjennom magesekken sendes det et hormonsignal som aktiverer trypsin. Trypsin og andre proenzymer (zymogener) blir produsert i inaktiv form for å unngå at den aktive formen skal bryte ned vevet i bukspyttkjertelen. Trypsinogen blir skilt ut gjennom bukspyttkjertelen og går ut i tolvfingertarmen, hvor selve aktiveringen foregår.
Aktiveringen av trypsin er autokatalytisk, dette vil si at nærværet av ett trypsin molekyl vil føre til rask proteolytisk kløyving av trypsinogen, som igjen fører til dannelsen av mer trypsin. I tillegg vil trypsin aktivere andre zymogener som fører til videre fordøyelse av polypeptidkjedene i tynntarmen.
Les mer i Store norske leksikon
Litteratur
- Berchansku, A; Bowlin, L; Canner, D; Hallowell, B; Harel, M, Oberholser, K; Jones, G; Prilusky, J. (2019) Retrieved from https://proteopedia.org/wiki/index.php/Trypsin
- Goodsell, D. (2003). Trypsin. Retrieved from https://pdb101.rcsb.org/motm/46
- Johannesen, Terje. (2017). Alfa1 antitrypsinmangel (lest 12.11.19). Retrieved from https://nhi.no/sykdommer/lunger/kols/alfa1-antitrypsinmangel/
- Mathews, Van Holde, Appling og Anthony-Cahill, 2013. Biochemistry, 4.eksemplar. Pearson Canada Ink. s. 459-461
- Worthington Biochemical Corporation (2019). Trypsin (lest 01.11.19). Retrieved from http://www.worthington-biochem.com/TRY/


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.