Nukleære batterier kan lages ved såkalt termoelektrisk energigenerering. Varmen som følger av radioaktiv nedbrytning, omformes til elektrisk energi. Slike batterier har spesielt blitt brukt som energikilde i værstasjoner i værharde strøk og i romfartøy der aktuelle radionuklider er 90Sr og 238Pu, men også i pacemakere med 147Pm eller 238Pu. Slike batterier erstattes nå etter hvert med andre energikilder, for eksempel litium-ionebatterier.
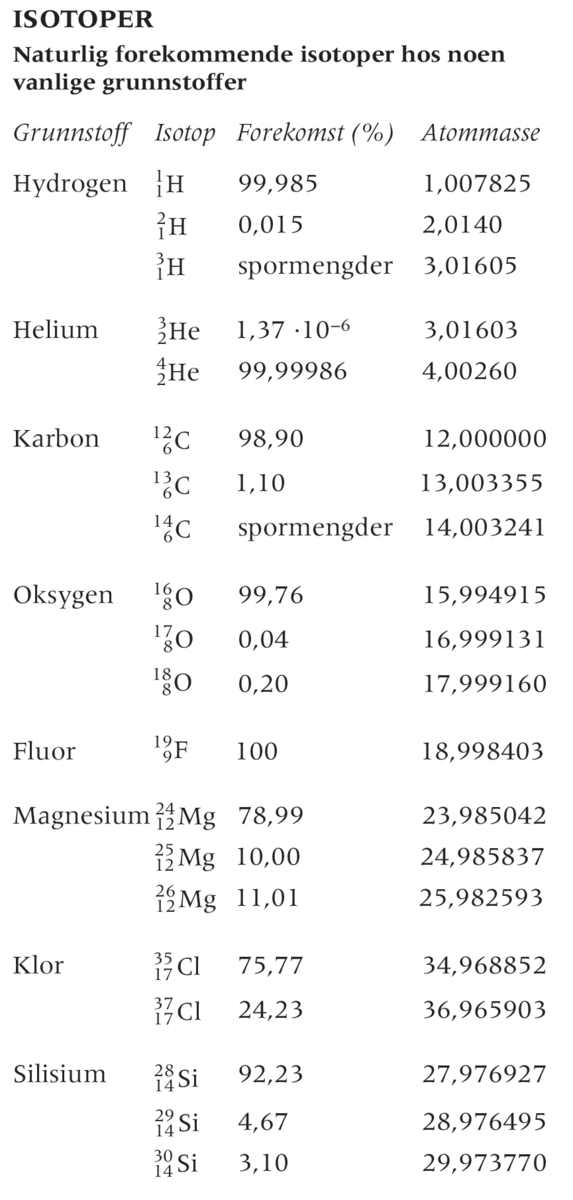
Ved storskala energiproduksjon, for eksempel i kjernekraftverk, brukes i dag hovedsakelig uranisotopen 235U, som kan fisjonere under påvirkning av langsomme (termiske) nøytroner. Den finnes bare i en konsentrasjon på 0,72 prosent. Den uranisotopen det er mest, av er 238U , men den er ikke fisjonerbar (eller fissil) med termiske nøytronenergier. Ordinære kraftreaktorer kan ikke kjøres med så lav 235U-konsentrasjon.
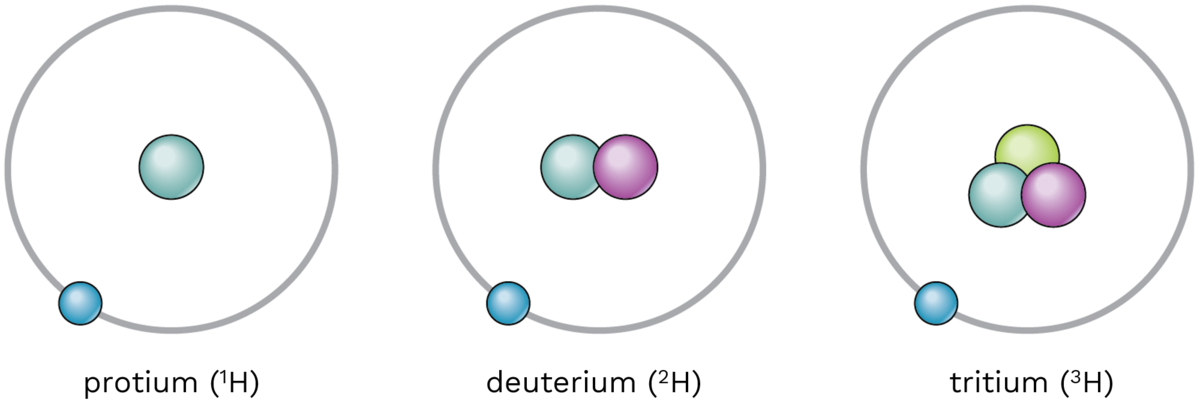
For framtidens mulige fusjonsreaktorer, der hydrogenatomer smelter sammen til heliumkjerner, utvikles det ekstra mye energi. Det har vært drevet intens forskning på denne mulige energikilden i mer enn 40 år, og det vil kanskje gå enda 30 nye år fra 2020 før vi får den første prototypen. Men i denne fusjonsprosessen er det deuterium som brukes. Den naturlige forekomsten av deuterium er bare på 0,015 prosent i hydrogen, men den må benyttes i tilnærmet ren form.
Både for fisjonsprosessen og fusjonsprosessen gjelder det altså at man trenger isotopanriket materiale. Isotopanrikning oppnås ved anvendelse av ulike metoder for isotopseparasjon som bruker det faktum at isotoper av både hydrogen og uran har noe ulike, hovedsakelig fysiske, egenskaper.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.