Diagnose stilles ved hjelp av radioaktive isotoper som er bundet til forskjellige målsøkende bæremolekyler. Disse bæremolekylene eller markørene søker seg til ulike syke vev og organer i kroppen hvor de konsentreres og kan registreres på grunn av strålingen de avgir. De biologiske markørene som benyttes er bygget opp av aminosyrer, proteiner eller karbohydrater og disse stoffenes molekylære egenskaper influerer på hvilke målsøkende organer og vev de oppsøker i kroppen.
Glukose er en viktig faktor for metabolismen. Glukose (FDG = fluoro-deoxy-glukose) benyttes derfor i stor grad som markør ved PET-diagnostikk av hurtigvoksende tumorvev og ved betennelse med rask metabolisme. Blodceller benyttes tilsvarende som markører for å studere blodgjennomstrømning og hjertefunksjonen.
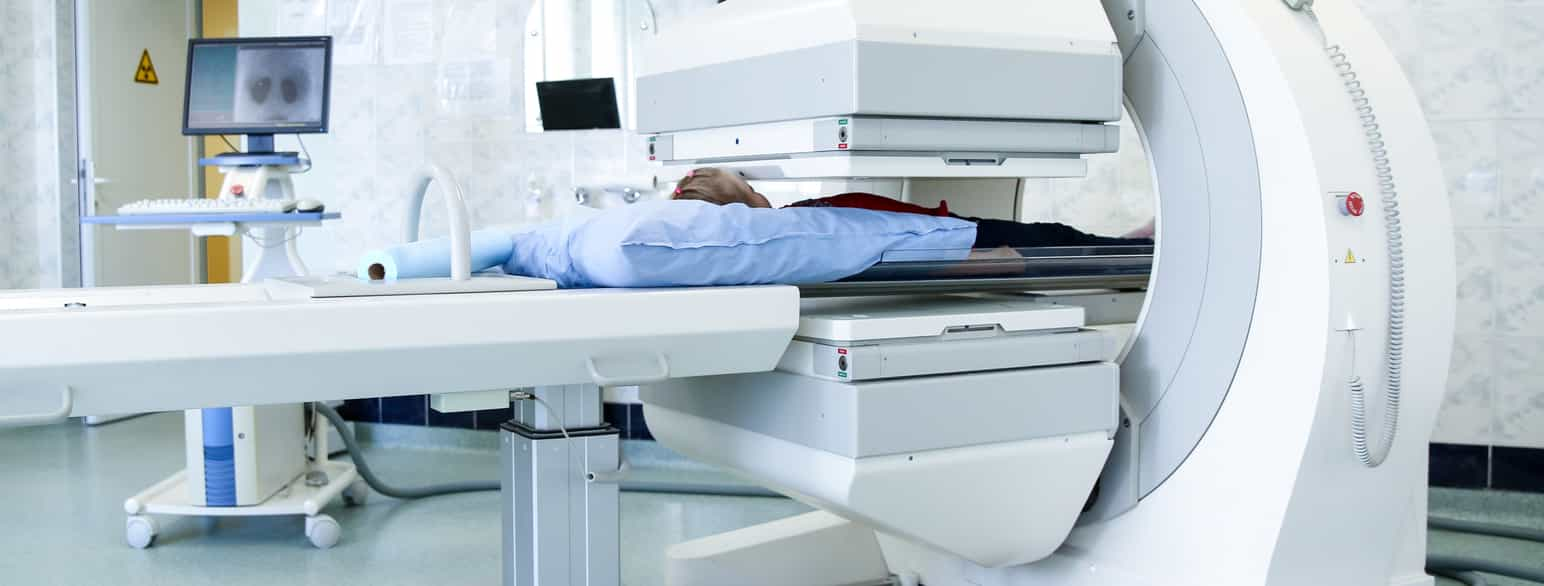
Radioaktive markører kan installeres i kroppen enten ved inhalasjon, oralt eller intravenøst. Etter at den radioaktive isotopen er tilført kroppen, blir pasienten lagt under en radioaktivitetsdetektor. Tiden undersøkelsen tar avhenger av teknikken som brukes og hvilke sykdomsprosesser som undersøkes. Det instrumentet som oftest brukes kalles gammakamera. Gammakameraet er koblet til en datamaskin som lager bilder av hvordan radioaktiviteten konsentreres og fordeles i det området eller organet som undersøkes.
Normalt vev i skjoldbruskkjertelen viser seg for eksempel som jevn radioaktivitet, mens nedsatt stoffskifte vises som en lavaktiv «kald knute» og økt stoffskifte som en høyaktiv «varm knute». Grafiske fremstillinger av målingene brukes ved ulike funksjonsundersøkelser. Et eksempel er kurver som viser om utskillelsen av urin fra nyrene er normal eller blokkert.
Strålingen fra pasienten kan fremstilles som todimensjonale såkalte scintigrammer eller tredimensjonale bilder. For SPECT skjer det tredimensjonale bildeopptaket ved at gammakameraet beveger seg tomografisk 360° rundt pasienten. De radioaktive isotopene som benyttes ved SPECT-teknikken sender ut gammastråler direkte.
PET benytter radioaktive isotoper som sender ut positroner. Disse genererer gammastråling når positronene kolliderer med elektroner i det biologisk aktive vevet. PET-skanneren består av en stasjonær ring med detektorer som påviser nøyaktig hvor i kroppen markøren er lokalisert og strålingen kommer fra.
Ved at isotopundersøkelser kombineres med røntgen, CT, PET-CT, MR, eller PET-MR, får man en betydelig mer presis anatomisk fremstilling av sykdomsforandringer og organfunksjoner enn man får ved tradisjonell gammakamerateknikk.



Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.