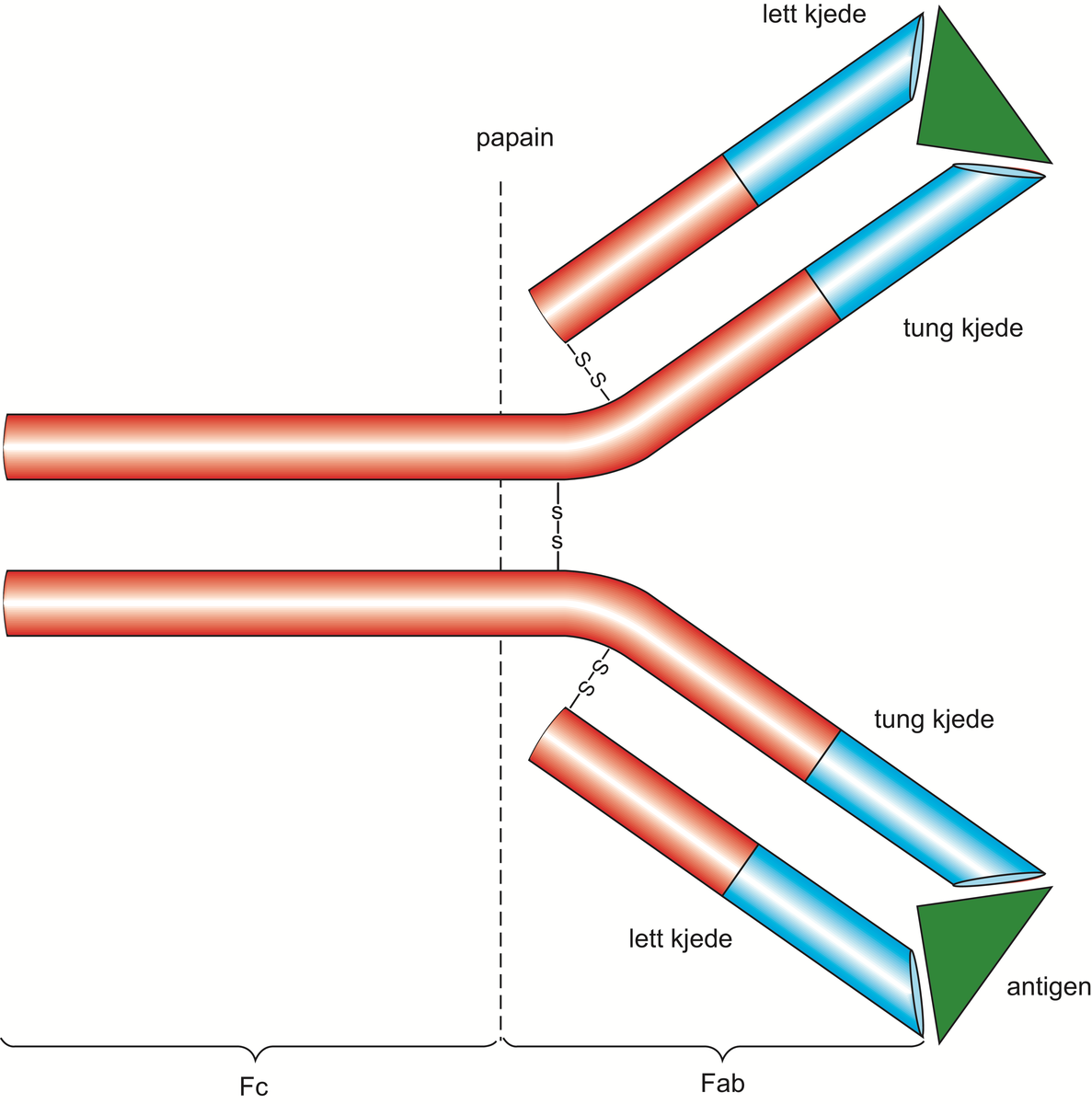
Lambda-lettkjeder er en type polypeptidkjeder som inngår som byggesten i alle immunglobuliner.
Immunglobulinene er normalt bygget opp av to tunge (IgG, IgA, IgM) og to lette polypeptidkjeder (kappa eller lambda). Lambda-lettkjeder kan påvises i blodserum eller urin ved immunelektroforese, enten som del av et komplett immunglobulin eller som frie lettkjeder. Det er mulig å bestemme mengden av frie (ikke bundet til tunge kjeder) lambda- og kappakjeder i serum. Dette brukes blant annet ved diagnostisering av sykdommen myelomatose.



Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.