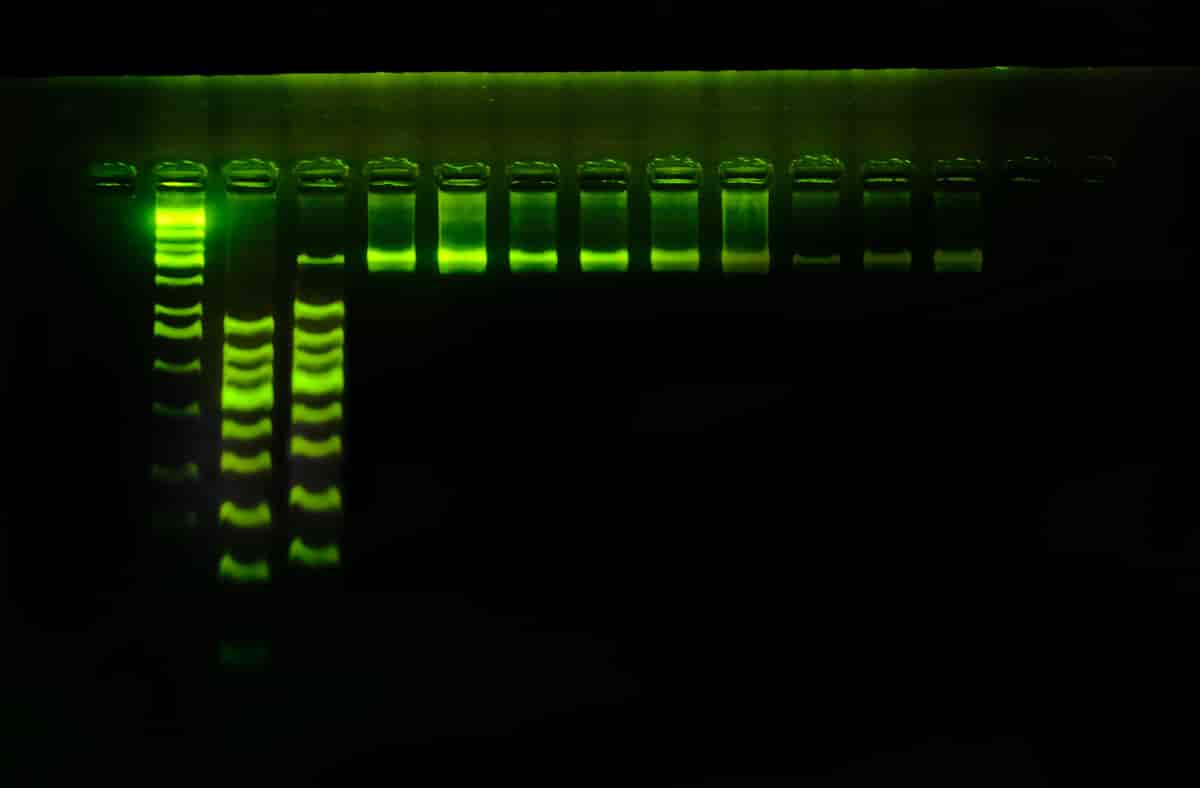
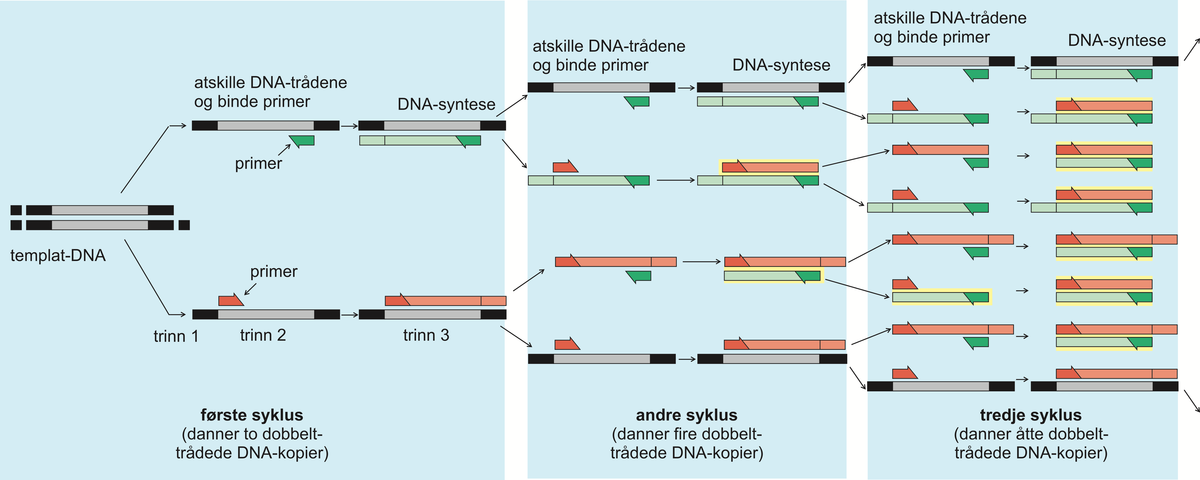
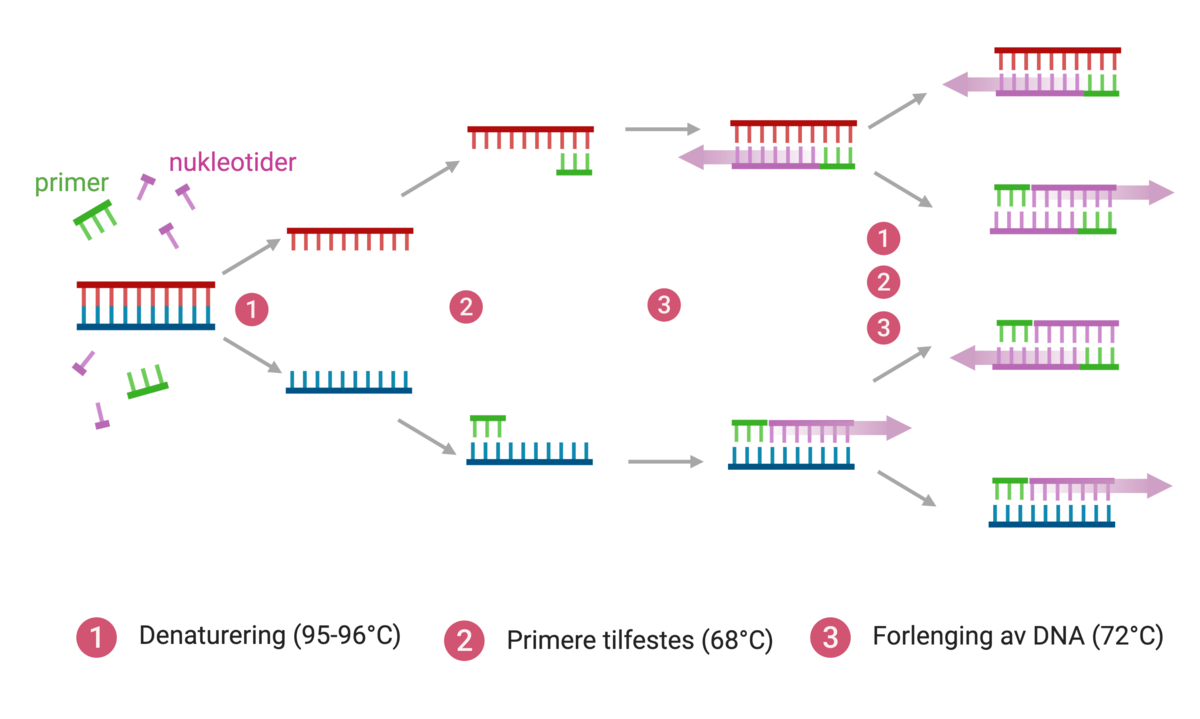
PCR er en metode som brukes til å amplifisere (øke mengden av) arvestoffet DNA (deoksyribonukleinsyre) eller RNA (ribonukleinsyre). Med amplifisering menes det at for hver runde med en PCR-reaksjon dannes det en kopi av hvert enkelt DNA- eller RNA-molekyl som var til stede i prøven fra begynnelsen av. Dette betyr at mengden DNA eller RNA i prinsippet øker eksponentielt med antallet sykluser med PCR-reaksjoner.
Faktaboks
- Også kjent som
- av engelsk polymerase chain reaction, PCR, PKR
Når PCR-metoden ble tatt i bruk i 1985 var det revolusjonerende for alt arbeid som ble gjort med DNA, spesielt innenfor genetisk og biologisk forskning. Dette skyldes at amplifiseringen kan gjøres selektivt, slik at bare enkeltgener eller noen få gener kopieres opp. Metoden er rask, og man kan fremstille DNA fra enkeltceller i relativt store mengder. PCR-metoden gjorde det mulig å identifisere og studere DNA-fragmenter som var til stede i minimale mengder, for eksempel i spytt eller en blod- eller sædflekk. Slike minimale mengder var tidligere for små til at de kunne identifiseres eller studeres, men takket være PCR-reaksjonen kunne man øke mengden DNA til stede i prøven til en mengde som var tilstrekkelig for å oppnå identifikasjon av en gjerningsmann.
PCR brukes blant annet til å identifisere bakterier og virus, og regnes som gullstandarden for blant annet diagnostisering av bakterie– og virus-infeksjoner. PCR brukes også i grunnforskning, men særlig i medisinsk genetikk og rettsgenetikk har den fått stor betydning.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.