Proteiner må tilføres gjennom maten som kilde til de aminosyrene som trengs for å bygge nytt protein i kroppen, for eksempel for barn som vokser eller personer som trener mye og dermed bygger muskler. Men selv for en voksen person som ikke bygger muskler er det nødvendig å tilføre proteiner gjennom maten. Årsaken er at kroppen som en del av vedlikeholdsarbeidet kontinuerlig bryter ned og bygger opp igjen kroppens proteiner.
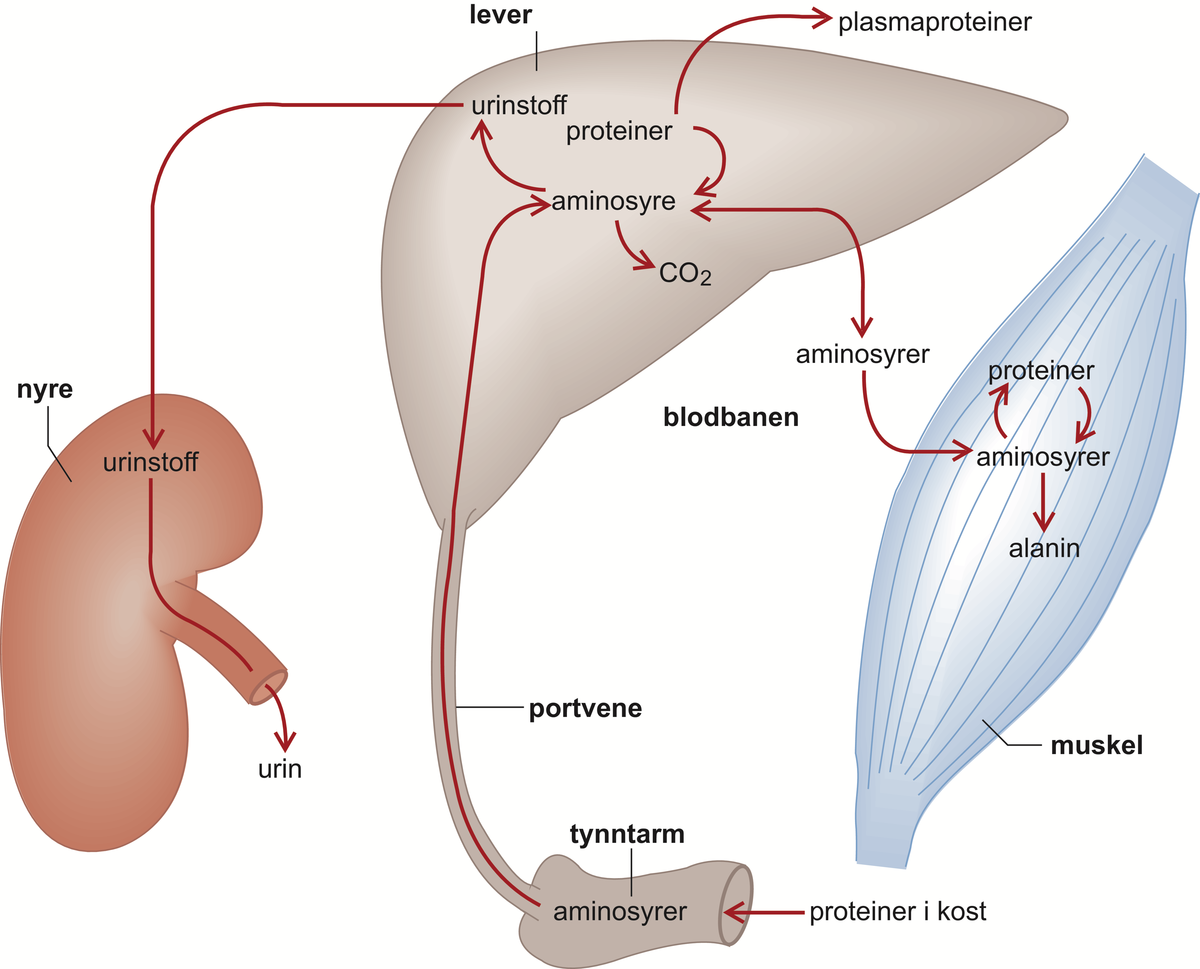
Proteinene blir brutt ned til aminosyrer, og disse blir så brukt til å bygge nytt protein. Blant annet som følge av at de rette mengdeforholdene av aminosyrer ikke er til stede til rett tid og kroppen ikke har noen mulighet til å lagre aminosyrer, vil noen aminosyrer bli oksidert, og nitrogenet vil bli skilt ut i urinen som urea. Dermed må kroppen tilføres aminosyrer for å erstatte disse selv når det ikke skjer noen netto proteinsyntese.
Omsetningen er raskest i leveren, beinmargen og tarmslimhinnen. Leveren produserer storparten av blodplasmaets proteiner. Omtrent halvparten av leverens protein skiftes ut i løpet av cirka ti døgn. Benmargen danner blodceller og bygger opp hemoglobin, mens tarmens slimhinne skal erstatte et stort fortløpende celletap, og i tillegg produsere en mengde enzymer. Proteinet i musklene skiftes ut mye langsommere, og i kollagenet i bindevev og knokler er omsetningen meget liten.
Aminosyrene som proteinene består av blir tilført ved at proteinene i maten brytes ned til aminosyrer i fordøyelseskanalen, for deretter å bli sugd opp gjennom tarmveggen (se også fordøyelse). Fra tarmen føres aminosyrene med blodet i portåren til leveren og herfra ut til vevene, hvor celler velger ut og tar opp de aminosyrene de har bruk for til å bygge opp sine egne proteiner. Dette skjer meget hurtig. Aminosyrene fra et måltid kan være innebygd i nytt vevsprotein få minutter etter at de er blitt tatt opp i blodet.
Kroppen har evne til å bygge de fleste av de 20–25 aminosyrene som kroppens proteiner består av selv, bare totaltilførselen av aminosyrer er stor nok, med unntak av de ni såkalt essensielle aminosyrene. Disse kan ikke kroppen danne selv ved ombygging av andre aminosyrer, og de må dermed tilføres gjennom maten.
De ni essensielle aminosyrene er lysin, metionin, isoleucin, leucin, tryptofan, treonin, valin, histidin og fenylalanin. Barn og unge har i tillegg behov for tilførsel av arginin fordi egensyntesen ikke er tilstrekkelig. Kvaliteten av proteinet som tilføres gjennom maten bestemmes dermed av i hvor stor grad innholdet av disse essensielle aminosyrene i matens protein matcher kroppens behov for disse aminosyrene. Matens proteinkvalitet uttrykkes ofte som biologisk verdi. Animalsk protein har generelt høyere biologisk verdi enn planteprotein.
De fleste proteiner inneholder rundt 16 prosent nitrogen, og mye av nitrogenet i kostholdet er bundet i proteiner. Man kan derfor få et mål på proteinbalansen i kroppen ved å bestemme urinens nitrogeninnhold. Under normale omstendigheter hersker det likevekt, det vil si at det skilles ut like mye nitrogen som det tas opp, og hvis proteinforbruket øker, stiger nitrogenutskillelsen tilsvarende. Dette skyldes at aminosyrer fra protein som tilføres utover det som trengs til å bygge proteiner, vil bli brukt som en energikilde, hovedsakelig ved å bli oksidert i leveren. I denne oksidasjonsprosessen dannes ammoniakk, og siden ammoniakk er giftig, omdannes denne til urea i leveren. Det er dermed svært krevende for kroppen å bruke protein som energikilde.
Proteiner gir mindre energi til bruk for fysisk aktivitet eller for å lagres som fett enn de andre energigivende næringsstoffene per vektenhet. Proteiner er derfor mindre fetende enn de fordøyelige karbohydratene stivelse og sukker, og mye mindre fetende enn fett. Matvarer med mye protein og lite karbohydrater og fett, for eksempel magert kjøtt og mager fisk, bidrar derfor positivt til energibalanse. Proteinrik mat har også i mange tilfeller vist seg å gi en langvarig metthetsfølelse, noe som ytterligere bidrar til et redusert energiinntak og dermed redusert risiko for fedme.
Nitrogenbalansen blir positiv (opptaket større enn utskillelsen) når nytt kroppsvev blir bygd opp. En slik positiv nitrogenbalanse finner man derfor hos barn og gravide, hos idrettsfolk under trening og hos rekonvalesenter etter avmagrende sykdommer. Omvendt betyr en negativ nitrogenbalanse at organismen mister vevsprotein. Det forekommer blant annet ved krefttilfeller, ved alvorlige infeksjoner, ved visse nyrelidelser, og dessuten ved en proteintilførsel som ikke kan dekke organismens minimumsbehov.
Noen av aminosyrene kan omdannes til glukose i leveren. Som en tommelfingerregel kan det dannes rundt et halvt gram glukose fra nedbrytningen av ett gram protein. Siden glukose blir en mangelvare ved lang tids faste fordi kroppens glukoselager er sterkt begrenset, forklarer dette hvorfor muskelmasse forsvinner i slike situasjoner. Aminosyrene kan også omdannes til fett, men i praksis skjer dette i svært liten grad.






Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.