Hemoglobin transporterer oksygen fra lungene og ut i vevene, og karbondioksid motsatt vei. Hemoglobinet er pakket inn i røde blodceller, som nesten utelukkende består av hemoglobin.
hemoglobin
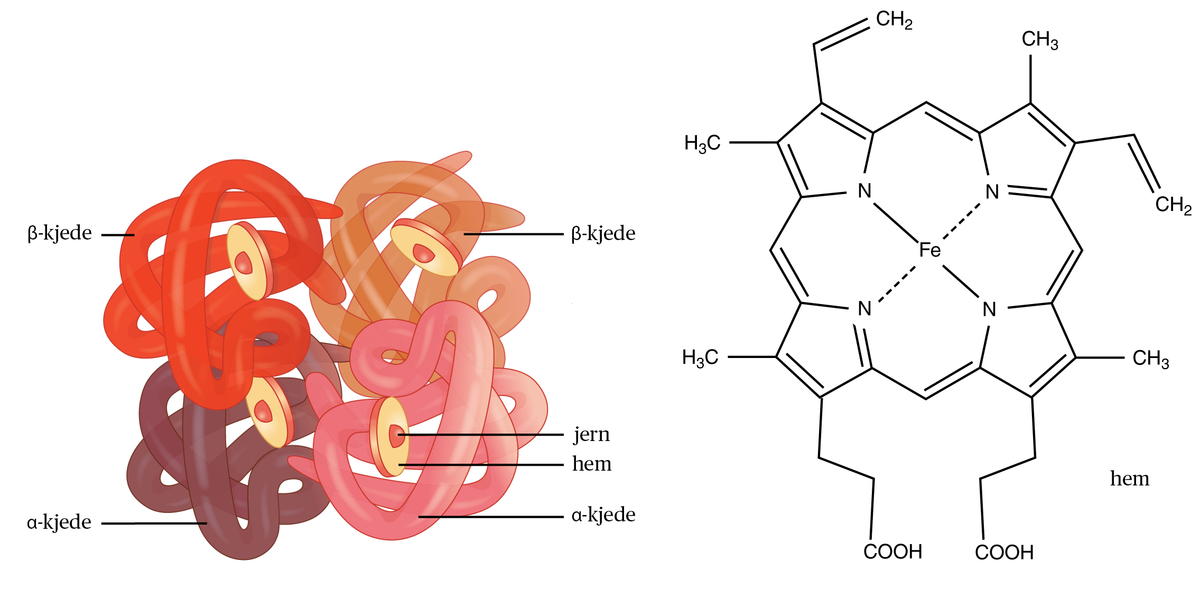
Struktur
Hemoglobinet består av tre bestanddeler: Jern, hem og globin. Det er fire globinkjeder med en hem-ring i hver av dem. I sentrum av hver hem-ring er et jernatom. Det er jernatomet som binder oksygen. Hem er porfyrin-ringer og er plassert i hydrofobe (vannavstøtende) lommer i globinkjedene. De har evne til å holde på et ekstra elektron slik at jernatomet holdes toverdig, kun da kan det binde oksygen. Globinkjedene er proteiner der aminosyre-sammensetningen gjennom millioner av år er tilpasset slik at oksygen og karbondioksid kan transporteres på en ideell måte.
Hemoglobin-typene
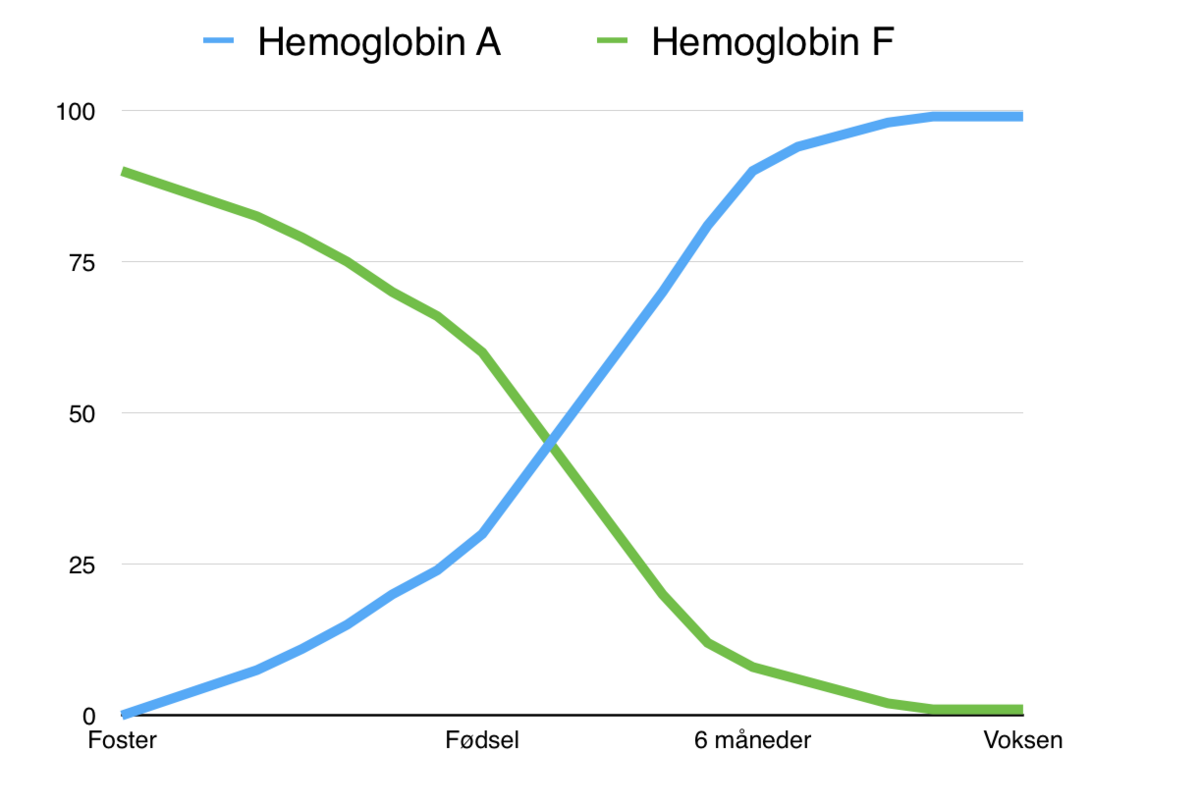
I voksenlivet består hemoglobinet av type A (HbA1 og HbA2). I fosterlivet er hemoglobin F den dominerende typen. HbF har sterkere binding til oksygen enn HbA slik at fosterets blod kan ta til seg oksygen fra morens blod i morkaken.
Det er fire forskjellige typer globinkjeder (α, β, γ og δ), og genene for dem finnes på kromosom 11 og 16. De forskjellige globinkjedene syntetiseres hver for seg og kombinerer seg med hverandre for å lage forskjellige typer hemoglobin. I fosterlivet, nyfødtperioden og voksenlivet aktiveres eller undertrykkes disse genene i et bestemt mønster.
I voksenlivet består hemoglobinet av type A (for adult). Det aller meste av A-hemoglobinet har to globinkjeder av α-type og to av β-type (HbA1). En liten andel på om lag 2 prosent har δ-kjeder istedenfor β-kjeder (HbA2).
I fosterlivet er hemoglobin F (for føtalt) den dominerende typen. Her er β-kjedene byttet ut med γ-kjeder. HbF har sterkere binding til oksygen enn HbA, slik at fosterets blod kan ta til seg oksygen fra morens blod i morkaken.
Oksygen dissosiasjonskurven
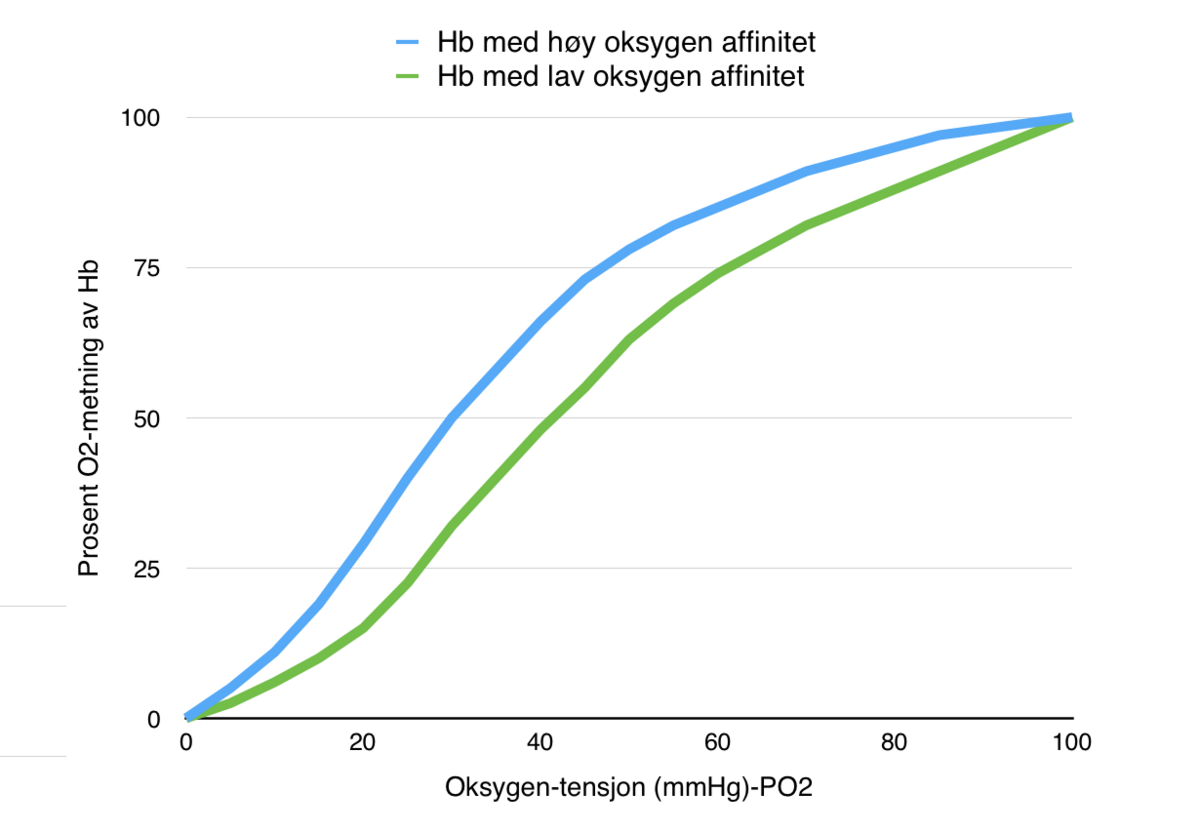
I lungene er oksygentrykket høyt og bindes til hemoglobin, mens i vevene er det lavere og frigis. Dissosiasjonskurven kan forskyves slik at hemoglobinet tilpasses situasjonen: Ute i vevene blir dissosiasjonskurven høyre-forskjøvet og mer oksygen frigis. Når blodet når lungene pustes karbondioksid ut og det motsatte skjer gjennom venstreforskyvning av kurven.
I lungene bindes oksygen til hemoglobin, mens i vevene frigis det. Når oksygenet frigis fra en av hem-ringene, vil det føre til en liten konformasjonsendring i hemoglobinmolekylet slik at de andre oksygen-atomene frigis lettere (hem-hem-interaksjonen). Derved er det mulig å få en S-formet dissosiasjonskurve, som er gunstig for å både frigi og binde opp mest mulig oksygen i henholdsvis vevene og lungene.
I tillegg kan hele dissosiasjonskurven forskyves slik at hemoglobinet tilpasses situasjonen:
Ute i vevene lages CO2 gjennom celleånding. Dette vil ved hjelp av enzymet karbonsyreanhydrase i de røde blodcellene reagere med vann og gi bikarbonat og proton (CO2 + H2O HCO3 - + H+). Protonet binder seg til globinet i hemoglobin og gir en liten konformasjonsendring slik at dissosiasjonskurven høyre-forskyves. På den måten frigis mer oksygen (allosterisk effekt). Når hemoglobinet når lungene, skjer det motsatte: CO2 pustes ut og protonkonsentrasjonen avtar. Da vil protonet slippes fri fra hemoglobinet, som så endrer form slik at oksygen bindes sterkere. Dette kalles Bohr-effekten etter den danske fysiologen Christian Bohr (1855–1911), som oppdaget fenomenet på starten av 1900-tallet.
På samme måte som for protonet kan dissosiasjonskurven også forskyves mot høyre via økt produksjon av 2,3-difosfoglyserat, forkortet 2,3-DPG. Dette er et produkt fra glukosemetabolismen, og produksjonen av det øker for eksempel ved hardt muskelarbeid slik at mer oksygen frigis til musklene.
Hemoglobin som syre-buffer
Karbondioksid (CO2) er avfallsstoffet når kroppens celler bruker oksygen til energiproduksjon. Hvis CO2 hoper seg opp, blir vevet og blodet surt (pH blir lav). Det er hemoglobinet som frakter det aller meste av karbondioksidet tilbake til lungene slik at det kan utåndes når vi puster. Noe CO2 bindes til globin-delen av hemoglobinet, men mesteparten av karbondioksidet fraktes tilbake til lungene som bikarbonat (HCO3-) etter at karbondioksid omdannes til bikarbonat og vann inne i de røde blodcellene (CO2 + H2O HCO3 - + H+). Denne reaksjon drives mot høyre fordi det ekstra protonet som lages, kan bindes opp til hemoglobinet.
Hemoglobin-konsentrasjonen
For å kompensere for den sterke bindingen mellom HbF og oksygen er hemoglobin-konsentrasjonen høyere hos fostre og nyfødte enn ellers. Derved får fosteret tilført nok oksygen til vevene. Hos nyfødte er hemoglobinkonsentrasjonen cirka 18 gram per desiliter (dl) blod. Deretter faller hemoglobinkonsentrasjonen gradvis og når sitt laveste nivå i andre til fjerde måned. Gjennomsnittlig er hemoglobinkonsentrasjonen da 11 gram per dl. Deretter stiger hemoglobinkonsentrasjonen gradvis til 14 gram per dl ved 12–14-årsalderen, hvoretter det utvikler seg en forskjell mellom kjønnene. Hos kvinner kommer hemoglobkonsentrasjonen gjennomsnittlig ikke høyere enn 14 gram per dl blod, mens den hos menn kommer til 15,5 gram per dl.
Nedbrytingen
Hemoglobin skiftes ikke ut i de røde blodcellenes levetid, som er cirka 120 døgn. Når de røde blodcellene når 120 dager, tas de ut i milten av makrofagene. Her brytes globin-delen ned til aminosyrer som gjenbrukes til andre proteiner. Jernet transporteres med transferrin til lever og beinmarg der det gjenbrukes. Hem brytes ned til bilirubin, som så skilles ut med gallen til tarmen.
Fritt hemoglobin er giftig for endotelet i blodårene, og kan gi betydelige skader på organer som nyrer og lever. Hvis fritt hemoglobin kommer ut i blodet, bindes det derfor til transportproteinet haptoglobin, som så frakter det til lever der det kan brytes ned.
Hemoglobinopatier og hemoglobintyping
Mutasjon i en eller flere globingener kan gi opphav til talassemi. Da lager man for lite α-kjeder (α-talassemi) eller β-kjeder (β-talassemi). De røde cellene blir små fordi de inneholder mindre hemoglobin enn normalt.
Sigdcelleanemi skyldes en punktmutasjon i β-globin-genet som resulterer i at hemoglobinmolekyler kobler seg sammen og lager lange kjeder (polymerisering).
Ved å gjøre hemoglobin-elektroforese kan man bestemme den innbyrdes fordelingen av hemoglobin-typene. Hvis det er relativt mye HbF i forhold til HbA, tyder det på β-talassemi.
Ved α-thalassemi vil det ikke være avvik på elektroforesen fordi det er α-kjeder i alle hemoglobintypene. Derfor må α-talassemi-diagnosen stilles gjennom gentest.
Les mer i Store norske leksikon





Kommentarer (4)
skrev Live Helbæk
svarte Thale Kristin Olsen
skrev Maria Zahl
Figurteksten sier: "Hem består av fire proteinkjeder."
Ifølge Britannica og Institutt for Biovitenskap (mn.uio.no/ibv/tjenester/kunnskap/plantefys/leksikon/h/hem.html) er ikke hem et protein.
svarte Halvard Hiis
Takk for at du sier ifra. Bildeteksten er rettet. Hilsen Halvard
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.