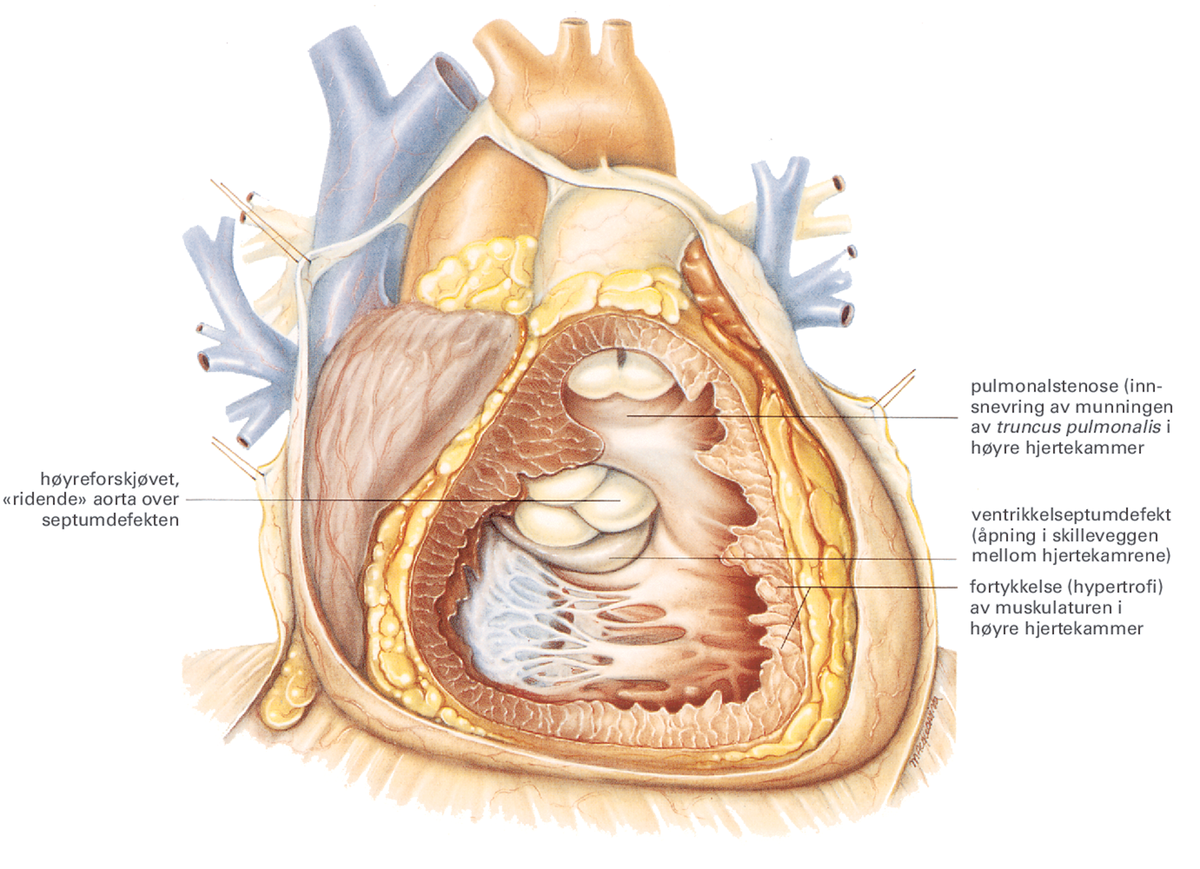
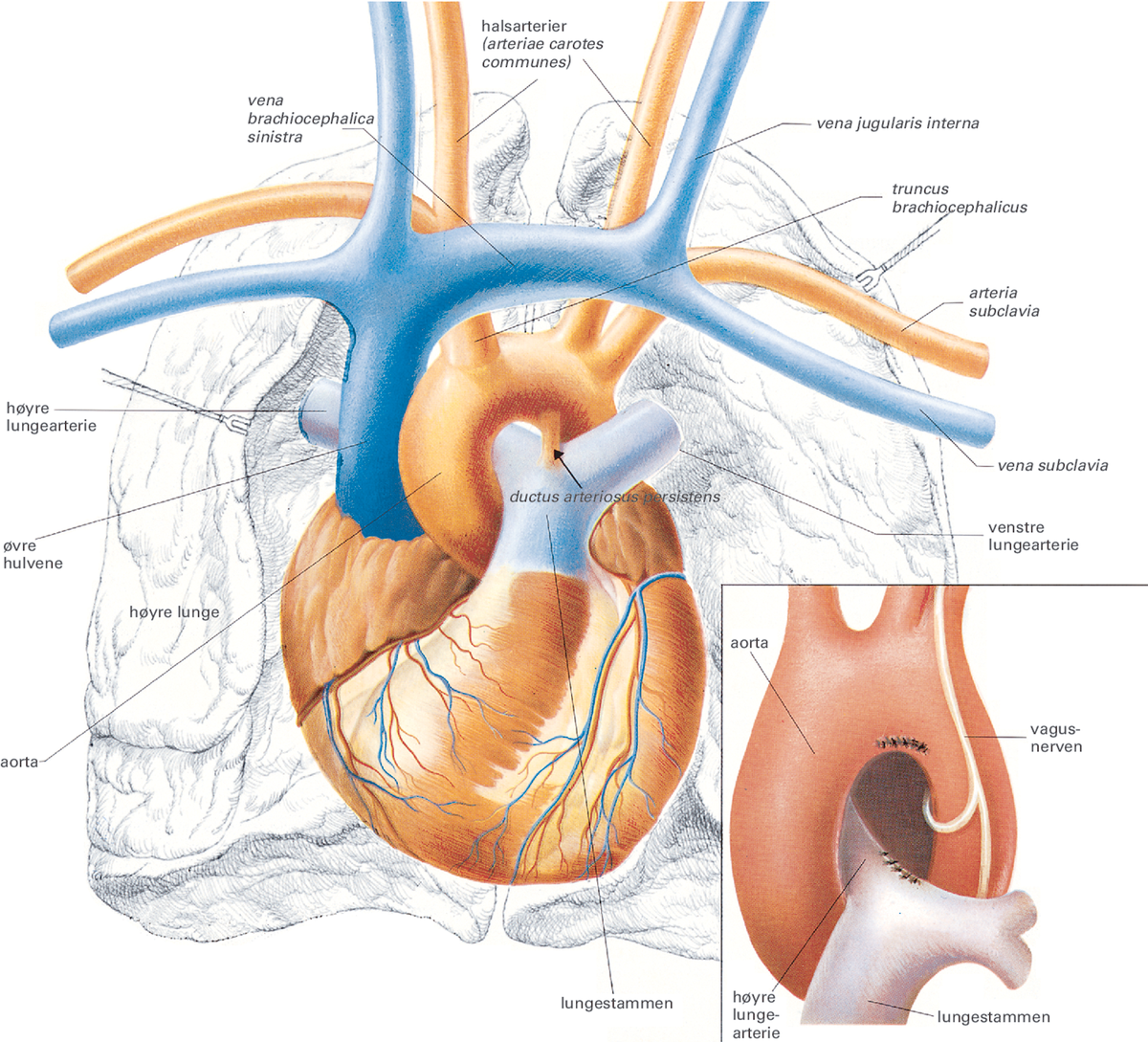
Hjertefeil er ethvert avvik fra den normale oppbygningen av hjertet. Avviket kan være medfødt eller ervervet i løpet av livet. Medfødte hjertefeil vil si feil i hjerteanlegget som i de fleste tilfeller oppstår tidlig i svangerskapet i slutten av første måned. Til de medfødte hjertefeilene regnes også feil knyttet til de store arteriene.
- Les mer om medfødte hjertefeil.
Til ervervede hjertefeil hører blant annet hjerteklaffefeil etter for eksempel giktfeber eller forandringer oppstått på grunn av for eksempel et hjerteinfarkt.



Kommentarer (2)
skrev Kristin Standish
svarte Georg Kjøll
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.