CRISPR er en genteknologisk metode der man gjør målrettede endringer i DNA i celler og organismer – såkalt genredigering. Forskningen begynte så smått i 1980-årene, med særlig viktige funn i 2010-årene. I 2020 ble Nobelprisen i kjemi tildelt to av bidragsyterne: Emmanuelle Charpentier og Jennifer Doudna.
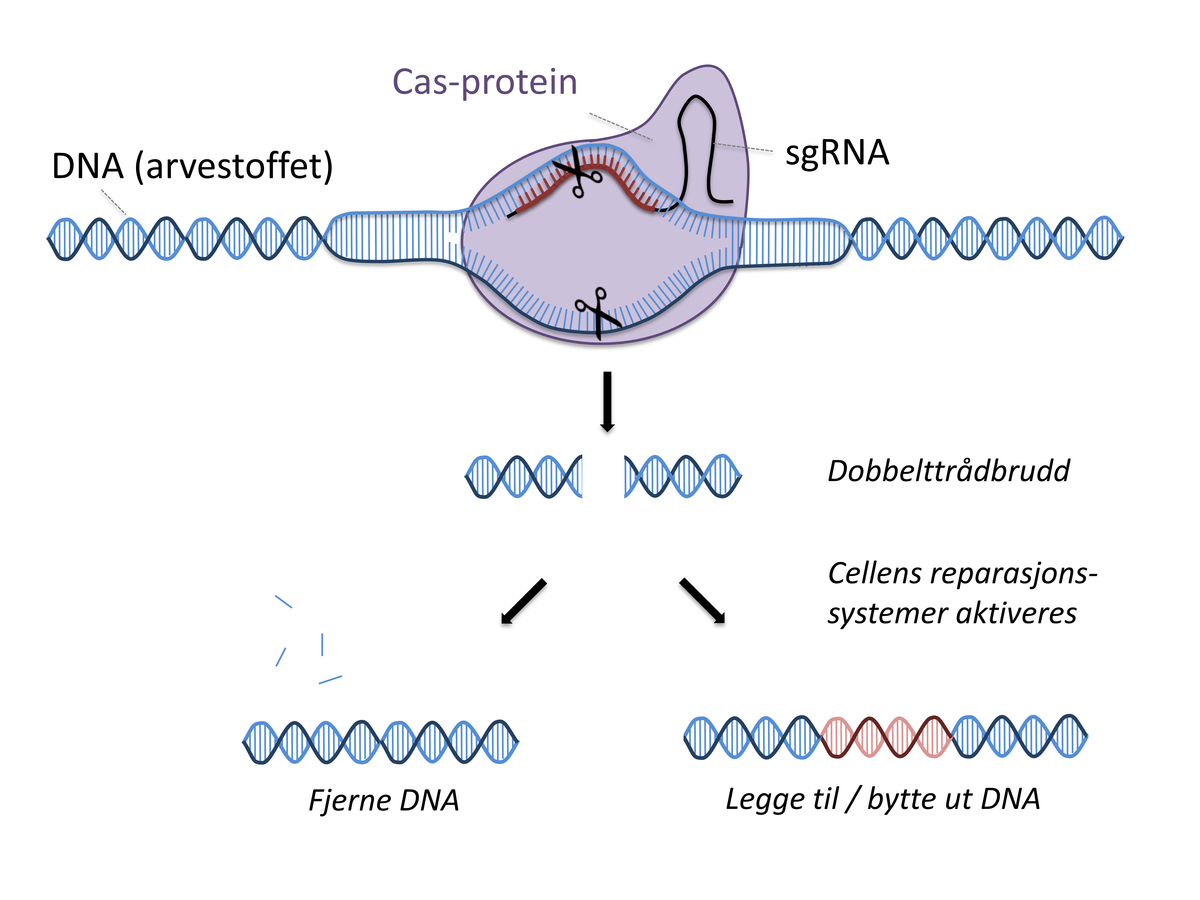
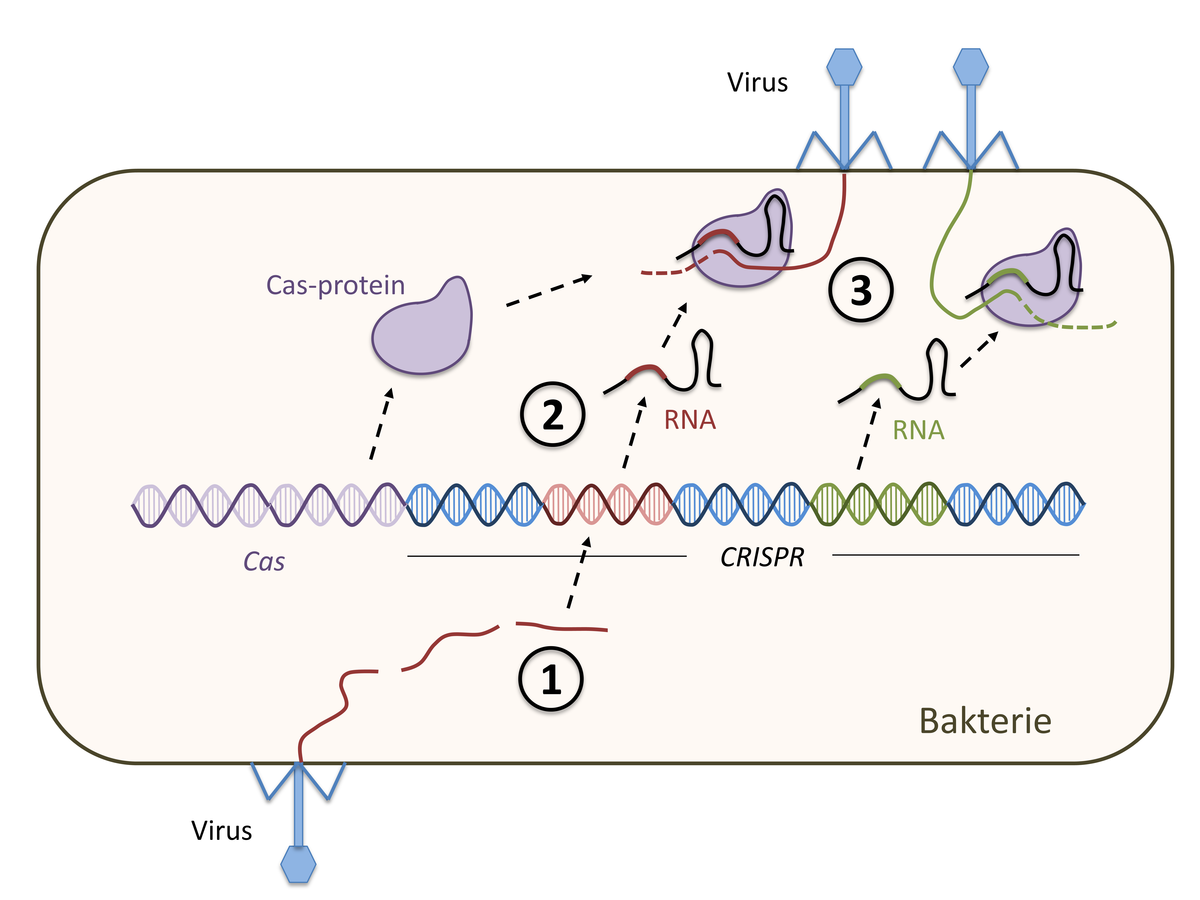
CRISPR er egentlig navnet på en type DNA-sekvenser som finnes i en rekke bakterier og andre mikroorganismer (prokaryoter) kalt Clustered Regularly Interspaced Short Palindromic Repeats. Disse utgjør en del av mikroorganismenes immunforsvar. Disse molekylene fra mikroorganismenes immunforsvar brukes som verktøy i den genteknologiske metoden.
CRISPR-metoden er enklere og billigere å bruke enn andre genteknologiske metoder. I tillegg gjør den det mulig å lage flere typer endringer enn med andre metoder, og flere endringer parallelt i samme celle. CRISPR-metoden skiller seg også fra mange andre metoder ved at den fungerer i alle typer organismer og celler.
En forutsetning for å redigere gener med CRISPR er at man vet sekvensen på DNA-et man vil endre. Det er også nødvendig å ha en god metode for å levere de aktive molekylene inn i cellene som skal endres. Hva som fungerer best, avhenger blant annet av hvilken type celle som skal redigeres, og hvilket bruksområde det er snakk om.
CRISPR-metoden brukes i forskning, medisin, matproduksjon, industriell bioteknologi og naturbevaring.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.