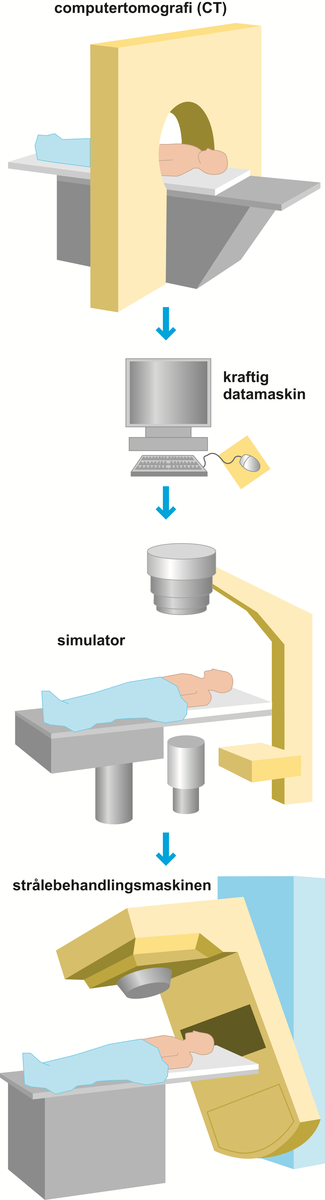
Strålebehandling er medisinsk behandling ved hjelp av ioniserende stråling. Strålebehandling er en viktig del av moderne kreftbehandling, og omfatter en rekke forskjellige tekniske metoder for å oppnå høy stråledose i svulstene.
Faktaboks
- Også kjent som
- stråling; stråleterapi; radioterapi
Strålebehandling i Norge blir utført ved onkologiske avdelinger ved regionsykehusene og ved noen sentralsykehus.
Strålebehandling ble tidligere brukt også ved tilstander som leddplager og hudlidelser. Dette brukes så å si ikke mer, fordi andre og mer effektive behandlingsformer er blitt tilgjengelig, og fordi risikoen for langtidsbivirkninger ikke står i forhold til gevinsten.



Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.