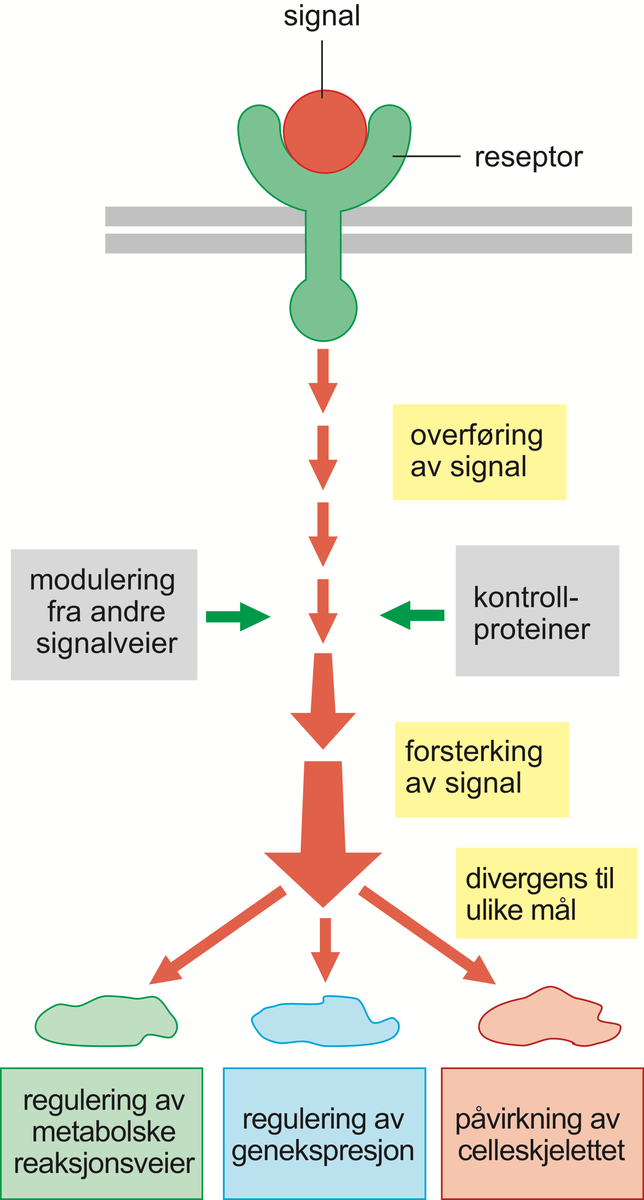
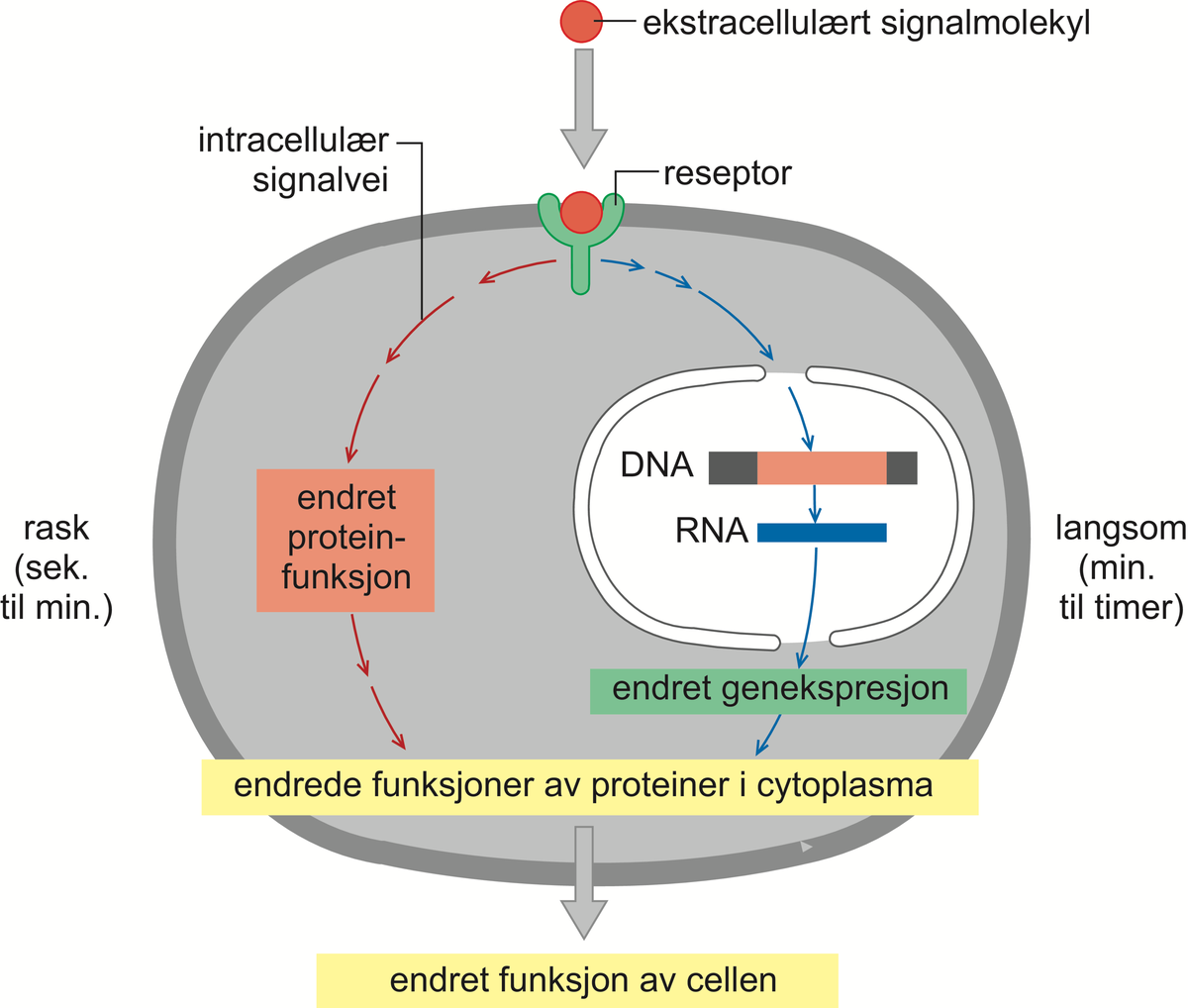
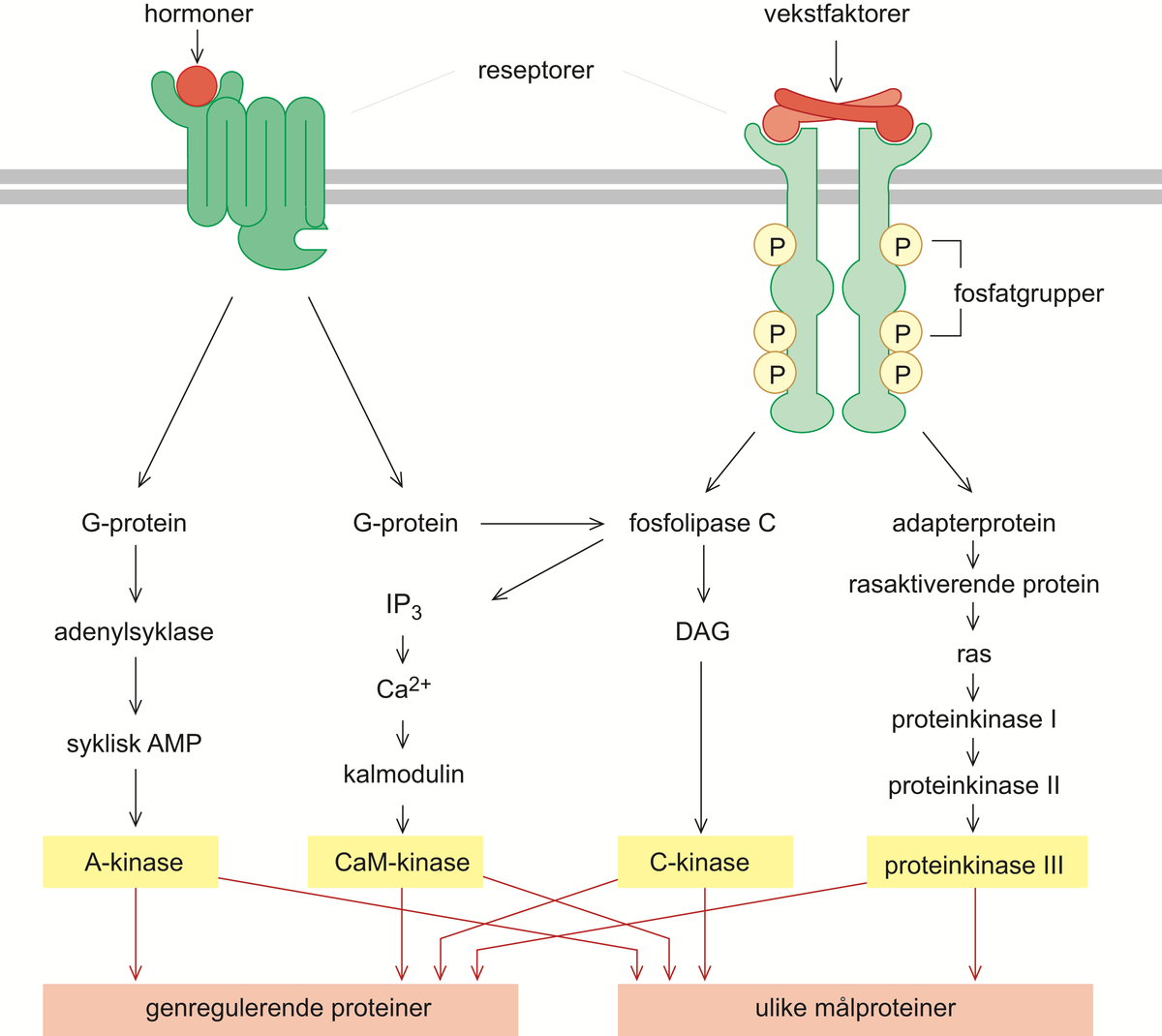
cAMP er et eksempel på en sekundær budbringer (engelsk second messenger). De primære budbringerne er de ekstracellulære signalmolekylene. Andre eksempler på sekundære budbringere er kalsiumioner (Ca2+) og de småmolekylære stoffene diacylglyserol (DAG, som er et lipid) og inositoltrifosfat (IP3, som er en sukkerart med tre fosfatgrupper bundet).
DAG og IP3 frigjøres ved at enzymet fosfolipase-C spalter et glykolipid, altså et fettstoff med sukkergrupper bundet, som er til stede i små mengder i cellemembranens innside. Dermed kløyves IP3 av og diffunderer innover i cellen, hvor det binder seg til og åpner kalsiumkanaler i endoplasmatisk retikulum. Kalsiumionene strømmer ut i cytosol, hvor de binder seg til og aktiverer ulike proteiner, spesielt et protein kalt kalmodulin. Kalmodulin-Ca2+-ionekompleksene kan så videre påvirke og aktivere nye proteiner, deriblant enzymet CaM-kinase (av calmodulin-aktivert kinase), som så fosforylerer og aktiverer nye proteiner.
DAG forblir i cellemembranen, hvor det binder til seg en annen viktig proteinkinase, kalt proteinkinase C, og holder den forankret til membranen. I nærvær av frigjorte kalsiumioner aktiveres enzymet og starter fosforylering av andre sett med proteiner. Fosfolipase C, som starter signalveiene som fører til aktivering av CaM-kinase og C-kinase, er normalt inaktivt, men stimuleres enten via aktiverte G-proteiner eller via såkalte enzymbundne membranreseptorer. Dette er en stor gruppe membranreseptorer som, når de ekstracellulære signalmolekylene binder seg til dem, enten selv får enzymaktivitet eller binder og aktiverer enzymer. Noen av de enzymbundne reseptorene utløser en signalvei der ras-proteinet aktiveres som et tidlig steg i veien. Aktivt ras medfører så stimulering av en serie med påfølgende proteinkinaser i en forsterkningskaskade. Denne signalveien er spesielt viktig i forbindelse med regulering av cellevekst og celledeling, men også de andre signalveiene bidrar til denne reguleringen.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.