HLA er en gruppe molekyler som finnes på overflaten av nesten alle celler i menneskekroppen. HLA-molekyler viser frem biter av stoffer fra en celles indre til celler fra immunsystemet, og har avgjørende betydning for immunsystemets virkemåte.
HLA
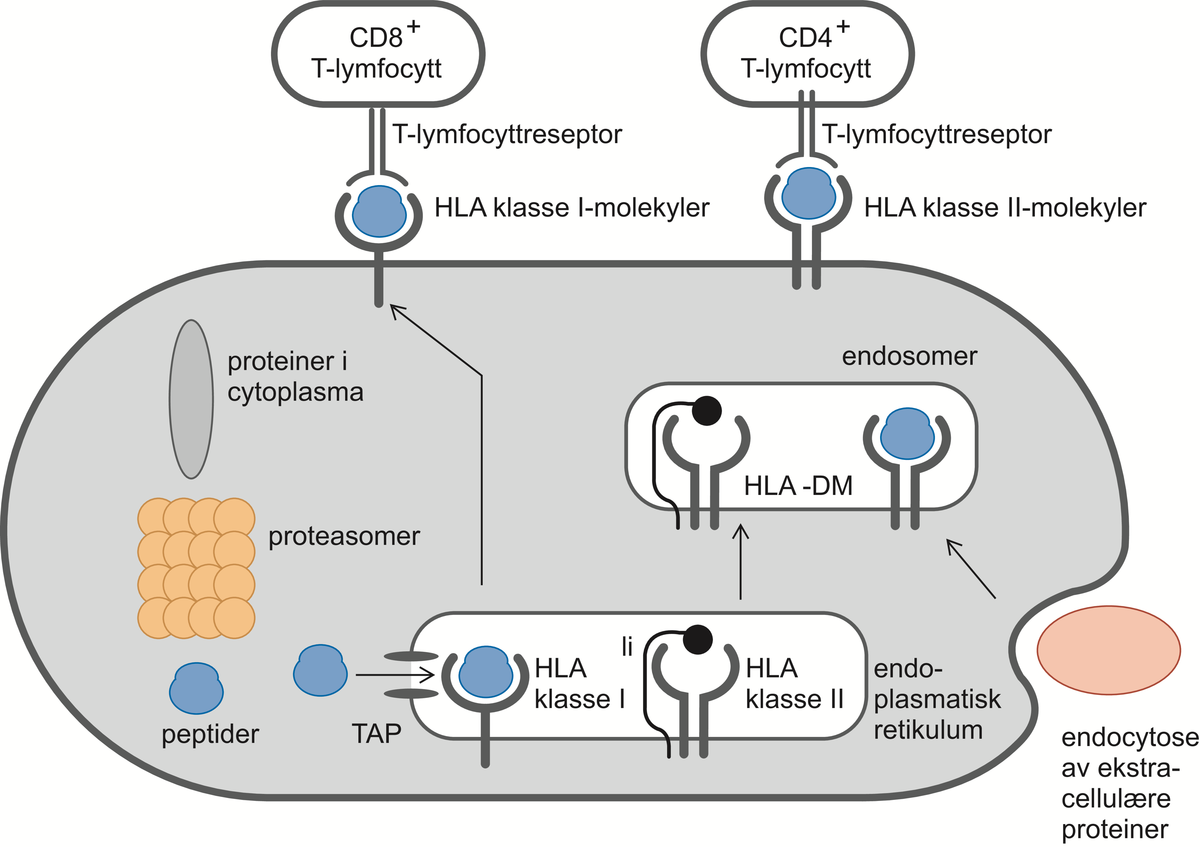
HLA. Figuren viser hvordan HLA-molekylene binder proteinfragmenter (peptider), transporterer dem til celleoverflaten og viser dem frem til T-cellene. HLA klasse I-molekyler presenterer peptider fra proteiner som er syntetisert i cytoplasma. Dette skjer ved at såkalte proteasomer splitter opp proteiner til peptider, som transporteres inn i endoplasmatisk retikulum av noen spesielle transportmolekyler, kalt TAP («transporters associated with antigen processing»). I endoplasmatisk retikulum blir peptidene bundet til HLA klasse I-molekyler som transporterer peptidene ut til celleoverflaten og viser dem frem til CD8 T-celler (dreperceller) som gjenkjenner HLA/peptid-komplekset ved hjelp av en spesiell reseptor, T-cellereseptoren. HLA klasse II-molekyler presenterer peptider fra proteiner som er tatt opp i cellen ved endocytose. Dette skjer ved at den såkalte invariantkjeden (Ii) transporterer HLA klasse II-molekylene inn i endosomene, hvor de binder peptider som stammer fra proteiner tatt opp ved endocytose. Deretter transporterer HLA klasse II-molekylene peptidene til celleoverflaten, hvor de vises frem til CD4 T-celler (hjelpeceller) som gjenkjenner HLA/peptid-komplekset ved hjelp av sin T-cellreseptor.
Virkemåter
Overvåkning
En celles tilstand og aktivitet vil gjenspeiles i stoffene som vises av HLA-molekylene på cellens overflate. I friske celler vises biter av stoffer som normalt finnes i disse, og celler fra immunsystemet vil da oppfatte cellen som frisk. I celler med smittestoffer, for eksempel der virus formerer seg inne i smittede celler, vil fremvisning av stoffer fra viruset identifisere cellen som smittet. På samme måte kan immunsystemet identifisere celler som ikke virker normalt, slik som kreftceller der biter av stoffer som oppstår i kreftceller vises av HLA-molekyler. Utfallet kan bli at immunsystemet oppdager og fjerner smittede celler og kreftceller. I tillegg kan immunsystemet angripe celler som stammer fra andre individer, slik som cellene i et transplantert organ. Det vil være forskjeller mellom ulike individers HLA-molekyler og stoffene som normalt finnes i friske celler, og disse forskjellene kan oppdages av immunsystemet.
Ervervet immunitet
Noen av immunsystemets celler, spesielt B-celler, makrofager og dendrittiske, kan aktivt ta opp smittestoffer uten selv å være smittet, bryte ned smittestoffene og vise frem, eller presentere, biter av dem på celleoverflaten med en egen klasse HLA-molekyler. Disse cellene vil ikke bli fjernet av immunsystemet, men vil istedenfor stimulere en annen type celler, T-celler, til å danne ervervet immunitet mot smittestoffene. Et eksempel er B-celler som blir stimulert av T-celler etter å ha presentert biter av smittestoffer med HLA til T-cellene. Denne type samhandling mellom B- og T-celler er nødvendig for dannelse av antistoffer som kan ta del i eliminering av de aktuelle smittestoffene.
HLA-molekyler gjenkjennes av bestemte celletyper i immunsystemet
Smittestoffer som presenteres med HLA-molekyler gjenkjennes av T-celler, og kun når de vises frem på overflaten til andre celler. Smittestoffer som presenteres med HLA-molekyler er i form av peptider fra virus, bakterier, sopp og parasitter, men kan også være fra proteiner produsert av cellen selv. Alle T-celler har en type reseptor for gjenkjenning av smittestoffer. Denne kalles T-cellereseptor, eller TCR, og binder både peptid og HLA samtidig. Hver T-celle som dannes, vil utvikle en unik TCR som kan binde et bestemt peptid og et bestemt HLA-molekyl. Det finnes millioner forskjellige T-celler i et individ, hver med en unik type TCR. Mangfoldet i repertoaret av forskjellige T-celler gjør sannsynligheten stort for at minst ett eller flere peptider fra et smittestoff vil kunne gjenkjennes av T-celler som selekteres fra repertoaret.
Det er to forskjellige typer T-celler: CD8 cytotoksiske T-celler og CD4 T-hjelperceller. Aktiverte CD8 cytotoksiske T-celler vil kunne drepe celler med peptid-HLA den gjenkjenner, for eksempel smittede celler, mens CD4 T-hjelperceller vil aktiveres ved binding av peptid-HLA til å stimulere cellen den aktiveres av, for eksempel å stimulere B-celler til å produsere antistoffer.
Naturlige dreperceller, eller NK-celler, er en annen celletype som kan gjenkjenne HLA-molekyler, men bruker reseptorer forskjellig fra TCR og gjenkjenner ikke smittestoffer. NK-celler kan oppdage endringer eller fravær av normale HLA-molekyler. Dette er viktig fordi noen virus vil skjule seg for T-celler ved å fjerne MHC molekyler fra cellene de har smittet, og fordi kreftceller kan slutte å produsere HLA-molekyler. NK-celler kan oppdage og fjerne celler som har endret eller som mangler HLA på overflaten.
Hovedtyper
Det finnes to hovedtyper HLA-molekyler: HLA klasse I og HLA klasse II. HLA klasse I-molekylene presenterer peptider til T-celler med CD8 cytotoksiske T-celler, mens HLA klasse II-molekyler presenterer peptider til CD4 T-hjelperceller.
HLA-molekylene består av to proteinkjeder. HLA klasse I har en alfa-kjede og et beta-2-mikroglobulin-molekyl, mens HLA-klasse II har en alfa- og en beta-kjede. Ytterst danner HLA-molekylene en grop, der molekylene kan binde peptider.
HLA klasse I
HLA klasse I-molekylene omfatter HLA-A, HLA-B og HLA-C. Disse har som oppgave å presentere peptider fra proteiner som blir produsert i cellens cytoplasma. Dette skjer ved at peptider som dannes ved nedbrytning av proteiner i cytoplasma, blir pumpet inn i endoplasmatisk retikulum. Der blir peptidene bundet til gropen på HLA klasse I-molekylene, som deretter transporterer peptidene ut på celleoverflaten slik at de blir vist frem til reseptoren på CD8 cytotoksiske T-celler.
HLA klasse II
HLA klasse II-molekyler omfatter HLA-DR, HLA-DQ og HLA-DP. Disse har som oppgave å presentere peptider fra proteiner som blir tatt opp i cellen ved endocytose. Når HLA klasse II-molekylene blir produsert i endoplasmatisk retikulum, binder de seg til et spesielt protein, invariant (Ii)-kjede. Ii-kjeden har to oppgaver. Den ene er å blokkere den peptidbindende gropen til HLA klasse II-molekylene, slik at gropen ikke blir fylt av peptider i endoplasmatisk retikulum. Den andre oppgaven er å transportere HLA klasse II-molekyler til endosomet, der HLA klasse II-molekylene «møter» materiale som er blitt tatt opp ved endocytose.
Når innholdet i endosomet blir surere (lavere pH), aktiveres nedbrytningsenzymer slik at både Ii-kjeden og endocyterte proteiner blir brutt ned til peptider. Dette gjør at HLA klasse II-gropen blir frigjort og kan binde endocyterte peptider. Såkalte HLA-DM-molekyler hjelper til med å tømme Ii-peptider fra gropen til HLA klasse II-molekylene, og til å laste opp gropen med peptider som stammer fra endocyterte proteiner. Når et peptid er bundet til gropen på HLA klasse II-molekylene, går de ut på celleoverflaten og viser frem peptidene til reseptoren på CD4 T-hjelperceller.
Genetikk
Genene som gir opphav til HLA-molekylene, finnes i et relativt stort genkompleks (omtrent fire millioner basepar) kalt major histocompatibility complex (MHC). Molekylene som produseres fra dette genkomplekset kalles ofte for MHC-molekyler, men hos mennesker kalles de også HLA-molekyler.
HLA-molekylene er kodet av gener som ligger tett sammen i MHC-genkomplekset på den korte armen av kromosom 6.
En karakteristisk egenskap hos HLA (MHC)-systemet er at det finnes svært mange genetisk bestemte varianter av HLA-molekyler. Det er nå påvist mer enn 8000 ulike alternative (alleliske) varianter av HLA-molekyler. Dette gjør at ulike HLA-molekyler kan binde peptider med ulik struktur. Mangfoldet av HLA (MHC)-molekyler øker sannsynlighetene for at det alltid skal finnes noen individer som skal kunne presentere fremmede proteiner til T-lymfocytter. Dermed kan ikke smittestoffene «lure seg unna» ved å utvikle proteiner som ikke bindes til HLA-molekyler. Dermed oppnår man en risikospredning, slik at noen individer innen en art vil overleve uansett hvilke epidemier som skulle oppstå.
Avstøtningsreaksjoner
Transplantasjoner mellom individer med forskjellige HLA-typer, gjør at T-cellene hos mottakeren gjenkjenner «fremmede» HLA-molekyler på overflaten på de transplanterte cellene og dermed starter en avstøtningsreaksjon. For å redusere risikoen for at celler og organ skal bli avstøtt, tilstreber man transplantasjon mellom individer med mest mulig lik HLA-type, eller vevsforlikelighet. Før transplantasjon må man derfor bestemme HLA-typen til giver og mottaker. Dette kalles HLA-typing.
Historie
HLA ble oppdaget i 1958 av den franske legen Jean Dausset (1916–2009), etter at han fant at pasienter som hadde fått mange blodtransfusjoner, dannet antistoffer mot antigener (HLA) på overflaten av hvite blodceller.
Les mer i Store norske leksikon




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.