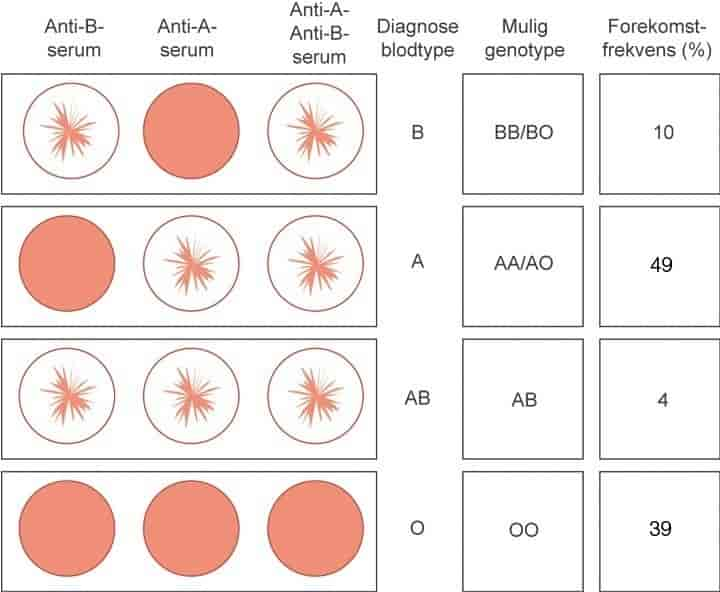
På 1600-talet eksperimenterte legar i både Frankrike, England og Italia med transfusjon, anten frå dyr til dyr eller frå dyr til menneske. Resultata var gjennomgåande nedslåande, og mange av pasientane døydde. Transfusjon blei bannlyst av paven. I England var ein utanfor jurisdiksjonen til paven, og fødselslegen James Blundell (1790–1878) gjorde nye forsøk på transfusjon omkring 1820, no med menneskeblod. Etter at Karl Landsteiner beskreiv ABO-systemet i 1900, følgde innføring av kjemikaliar som hindrar koagulasjon av blod, og gradvis utvikling av oppbevaringsvæsker for blod. Dermed låg forholda til rette for sikrare bruk av transfusjon som pasientbehandling.
Blodbankar blei oppretta i dei fleste europeiske land rett etter andre verdskrigen, og med utvikling av transfusjonsmedisinen blei transfusjon etter kvart ein viktig del i behandlinga av mange ulike sjukdommar verda over.
Globalt blir det tappa om lag 115 millionar einingar blod ved 13 000 blodbankar, og opp mot 100 millionar einingar raude blodceller blir transfunderte årleg. Omtrent 55 millionar posar plasma (à 250 milliliter) blir transfunderte, medan 45 millionar kg (90 prosent plasmaferese) blir industrielt smittesikra og fraksjonert til plasmaprotein. Transfusjonsindustrien har blitt ein global mangemilliardindustri.
Noreg er sjølvforsynt med omsyn til raude blodceller og blodplater. Smittesikra plasma må importerast fordi norsk plasma ikkje fyller Europeiske krav til innhald av hepatittantistoffer. Det norske forbruket av intravenøst immunglobulin (IVIG) og subkutant immunglobulin (SCIg) er høgt og produksjonen krev meir enn fire gonger de 45942 kg plasma Noreg leverte til fraksjonering i 2021. Lågare tersklar for transfusjon og mindre invasive kirurgiske teknikkar har redusert forbruket av raude blodceller frå om lag 200 000 einingar i byrjinga av dette hundreåret til 150 000 einingar i 2021, medan forbruket av blodplatekonsentrat og smittesikra plasma ligg meir stabilt på rundt høvesvis 25 000 einingar og 45 000 posar (à 200 milliliter).





Kommentarar (2)
skreiv Anne Spurkland
svarte Bjarte Gees Solheim
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.