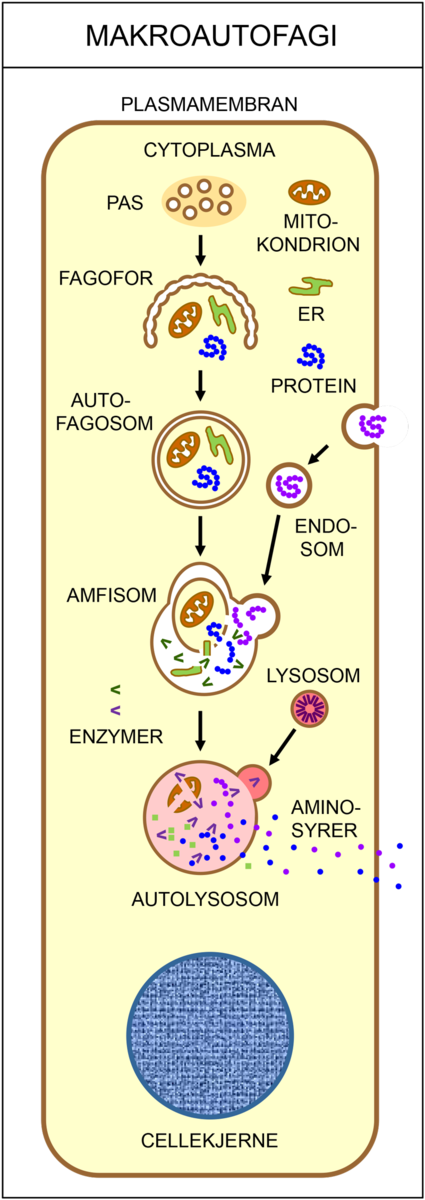
Autofagi er en samlebetegnelse for prosesser hvor celler pakker inn og fordøyer deler av sitt eget innhold (cytoplasma). Autofagi spiller en viktig rolle i å opprettholde et stabilt indre miljø i cellene (homeostase), og finnes hos alle eukaryote celler, som i gjær, sopp, planter, dyr og mennesker. Materialet brytes ned til små molekyler som seinere kan resirkuleres av cellen selv eller av organismen. Autofagi er derfor en viktig forsvarsmekanisme i kroppen ved langvarig sult. I tillegg kan autofagi påvirke utviklingen av visse sykdommer, som for eksempel kreft, Alzheimers sykdom og infeksjoner.
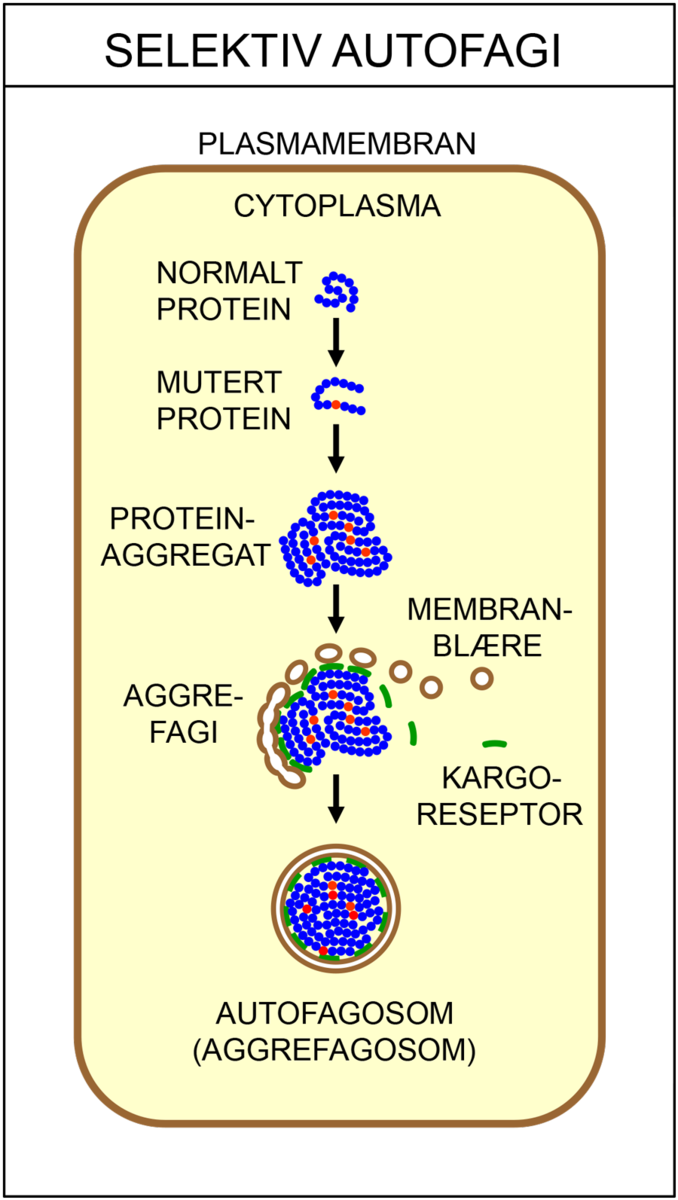
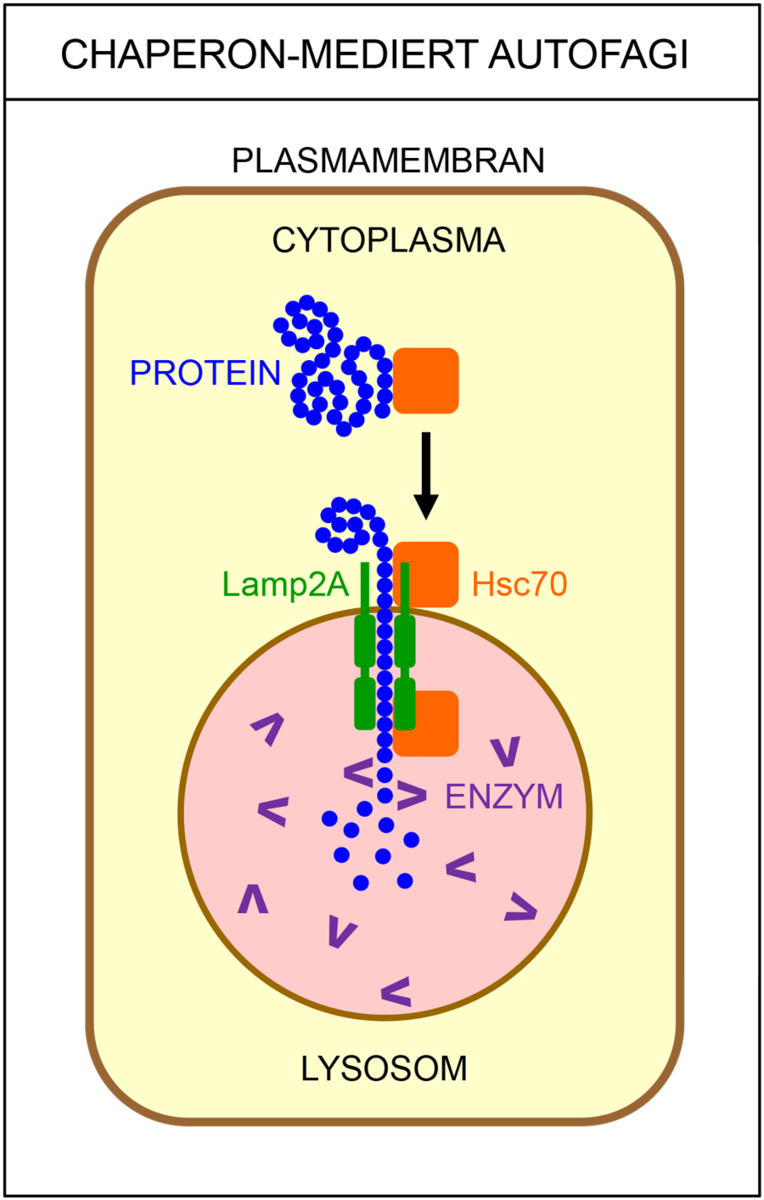
Det finnes flere ulike typer autofagi. Makroautofagi vil si at cellen fordøyer større deler av cytoplasma. Da brytes proteiner ned til mindre byggesteiner (aminosyrer), som kan brukes på nytt når cellene skal bygge nye, livsviktige proteiner. Ved selektiv autofagi bryter cellen ned utvalgte strukturer, som for eksempel mitokondrier eller ribosomer. Ved mikroautofagi fjernes gamle, opphopede og feilfoldede proteiner, samt andre store molekyler som ikke lenger har noen funksjon i cellen. I chaperonindusert autofagi blir skadede proteiner pakket av chaperoner sendt til nedbrytning.
Merking med ubikvitin og nedbrytning via proteosomene er forskjellig fra autofagi; disse prosessene brukes for å bryte ned spesifikt merkede proteiner med kort levetid.


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.