Mitokondrier finnes i alle eukaryote celler, som plante-, dyre- og soppceller, samt alger og encellede dyreceller (inkludert protister). Prokaryote organismer har derimot ikke mitokondrier.
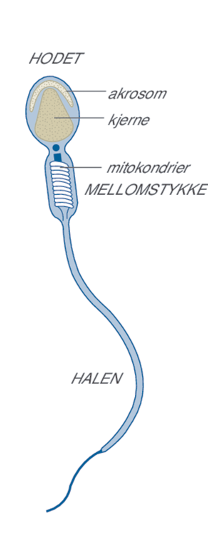
Antallet mitokondrier kan variere enormt avhengig av organisme, vev og celletype. Røde blodceller har ikke mitokondrier, mens én levercelle kan ha mer enn 2000 mitokondrier. Sædceller har 50—75 mitokondrier pakket rundt midtstykket. Encellede eukaryote organismer har færre mitokondrier per celle enn det celler i flercellede organismer har.
Antall mitokondrier i en celle gjenspeiler cellens energibehov. Celler med høyt energiforbruk, for eksempel muskelceller, har svært mange mitokondrier. I muskelceller øker også antallet mitokondrier med trening. Antallet mitokondrier i en celle kan også reguleres avhengig av energibehovet.
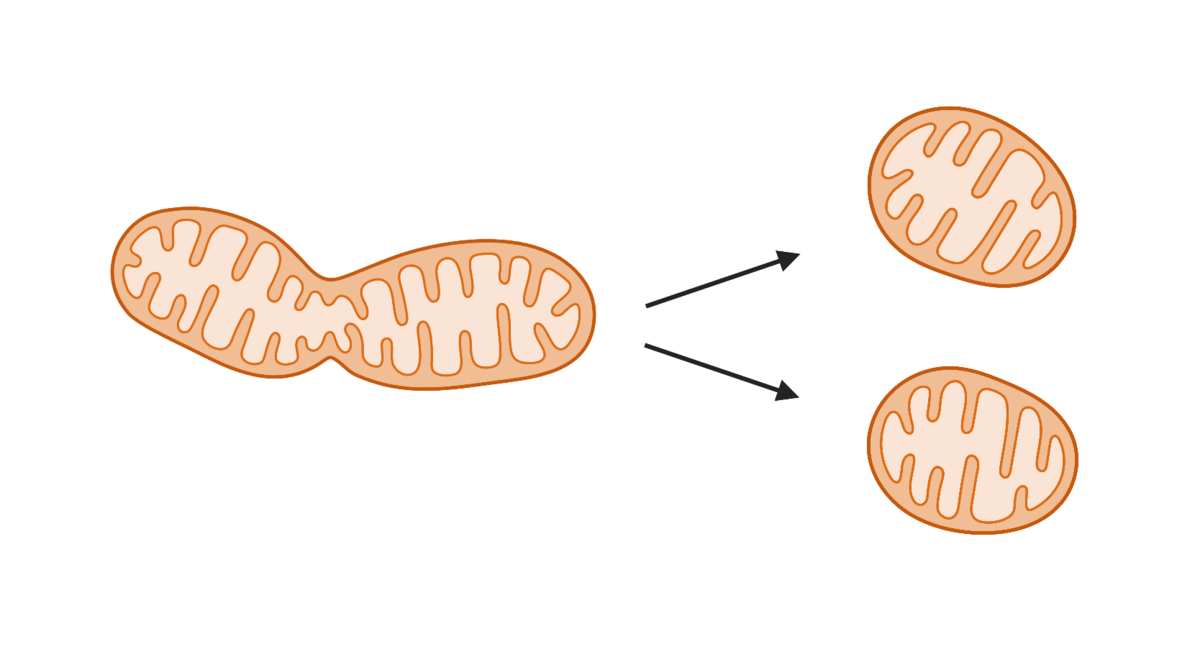
Mitokondriene kan både dele seg (mitokondriell fisjon) og smelte sammen (mitokondriell fusjon). Mitokondriell fisjon er viktig for å erstatte ødelagte mitokondrier, opprettholde antallet mitokondrier når cellene deler seg, men er også involvert i å regulere celledød. Mitokondriell fusjon antas blant annet å være en respons på sult for å unngå å bli degradert ved hjelp av autofagi. Gamle og ødelagte mitokondrier fjernes fra cellen gjennom en prosess som kalles mitofagi, det vil si autofagi av mitokondrier.
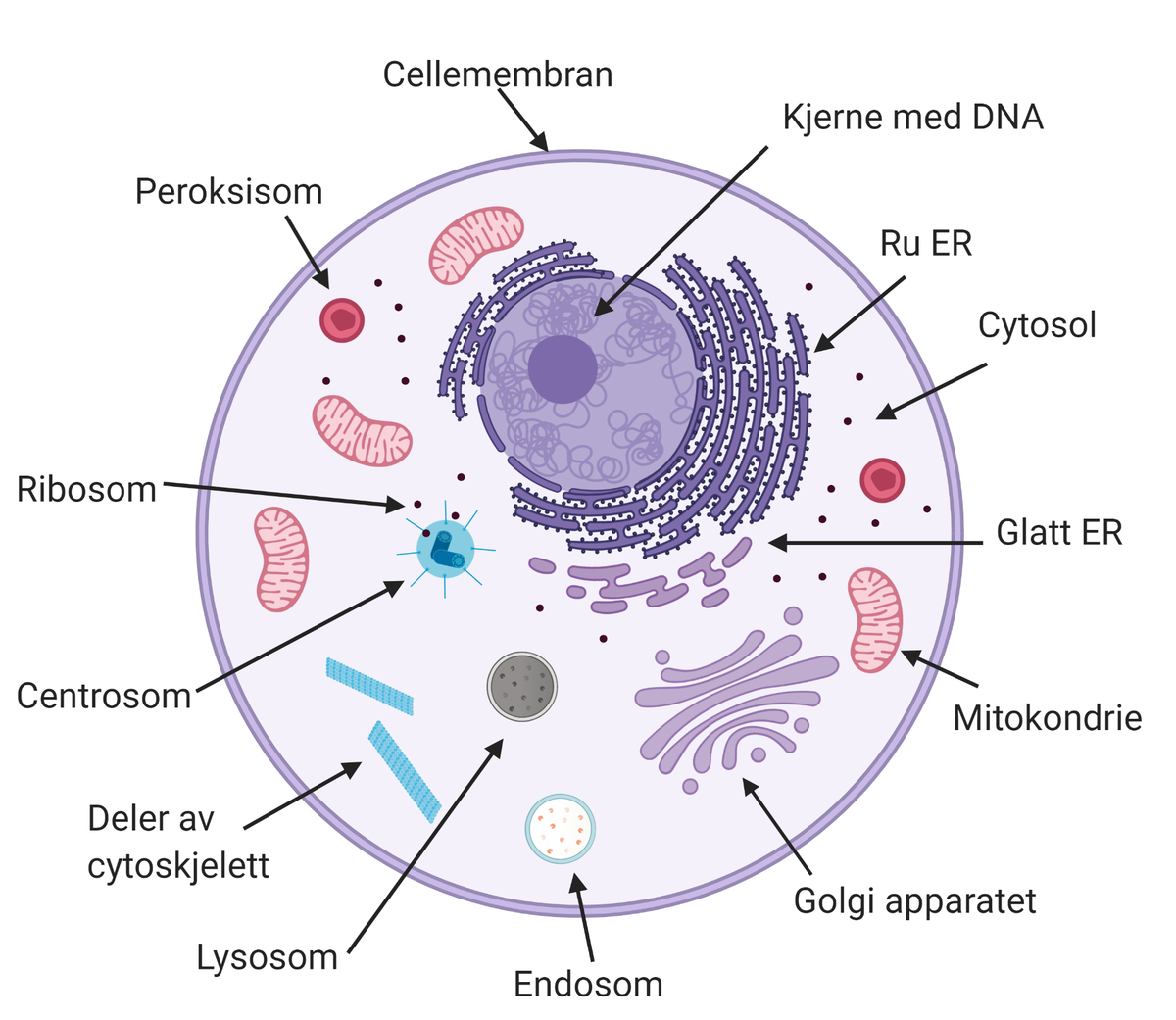
Mitokondrier kommuniserer med hverandre og med andre organeller, som endoplasmatisk retikulum, cellekjernen og peroksisomer, for å opprettholde cellens funksjon.



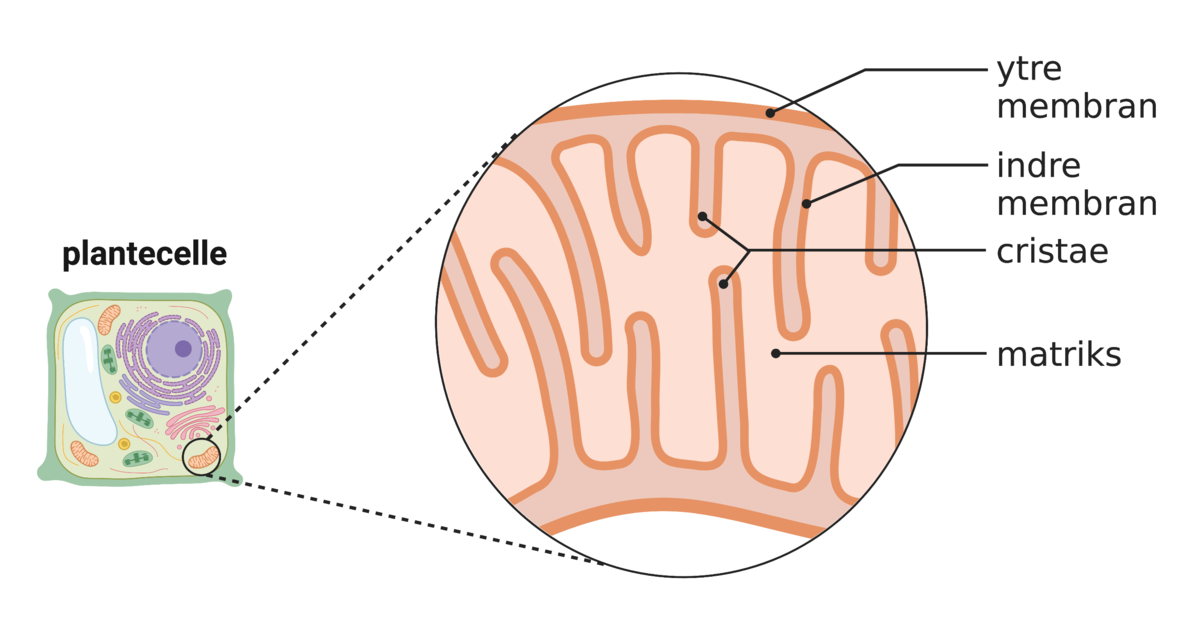
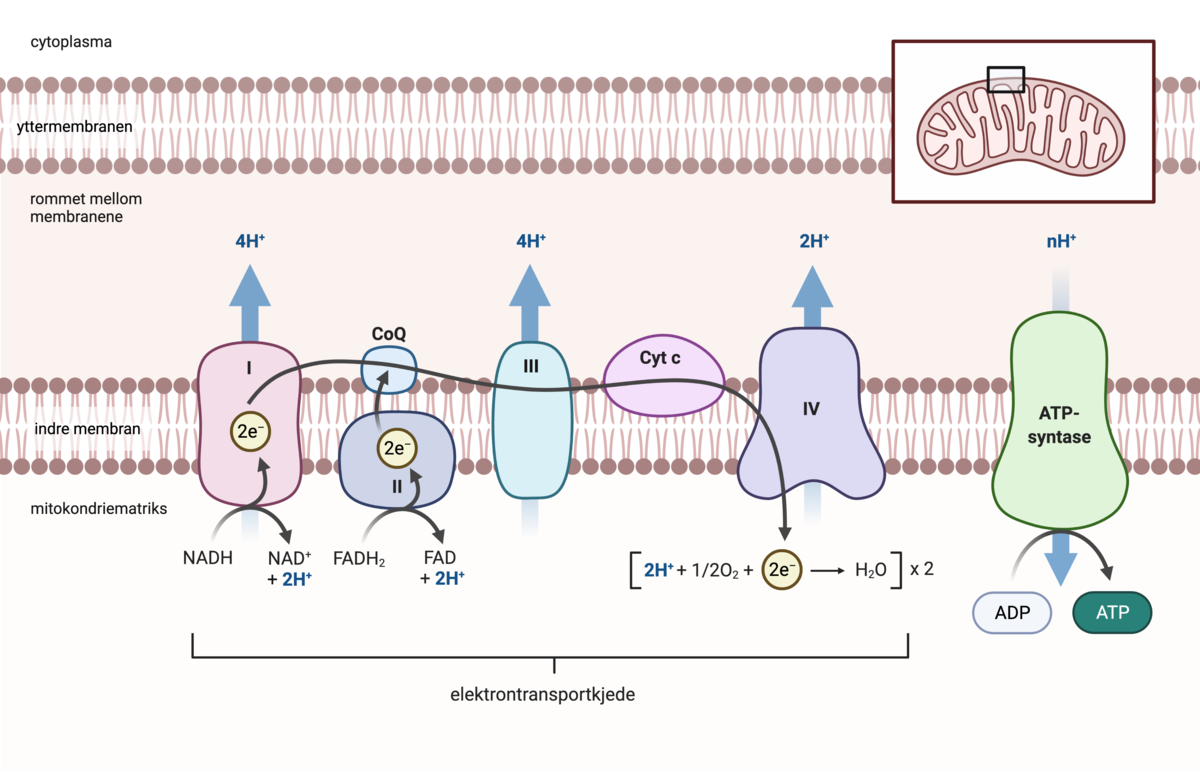
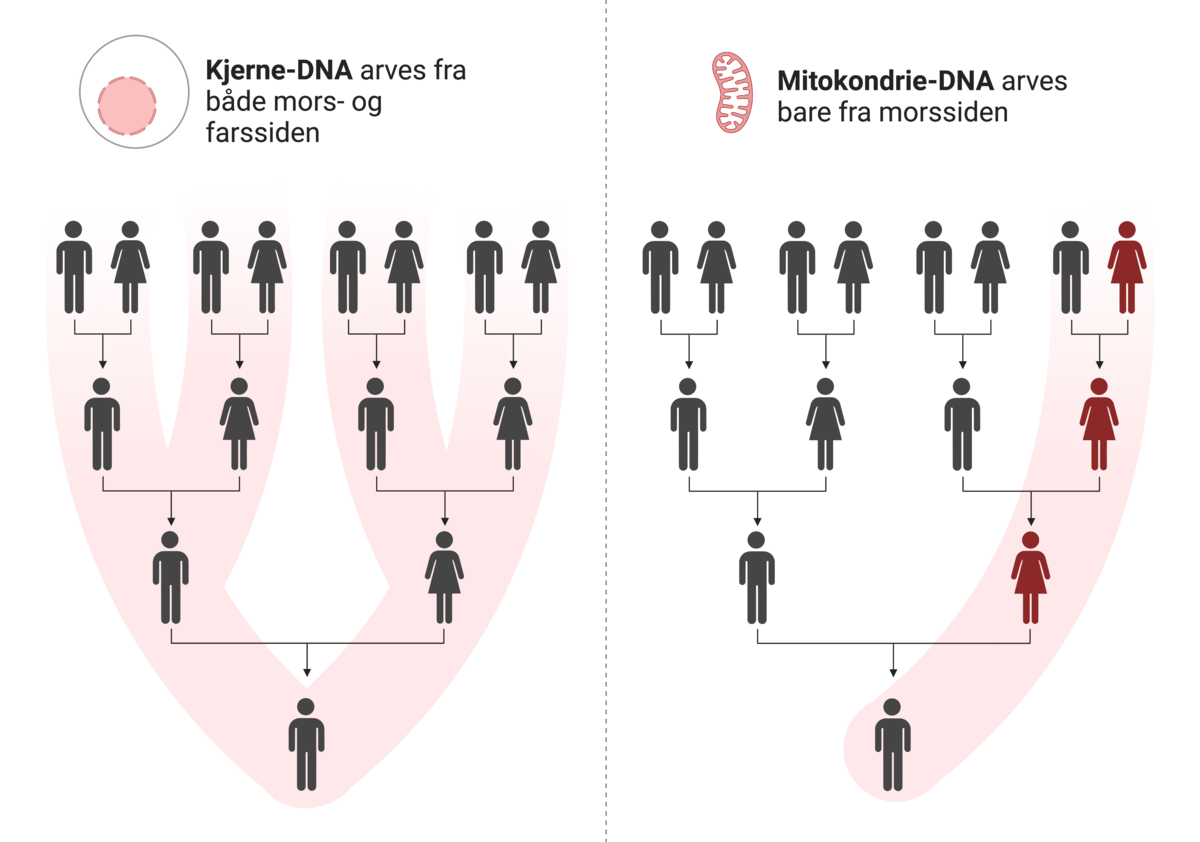


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.