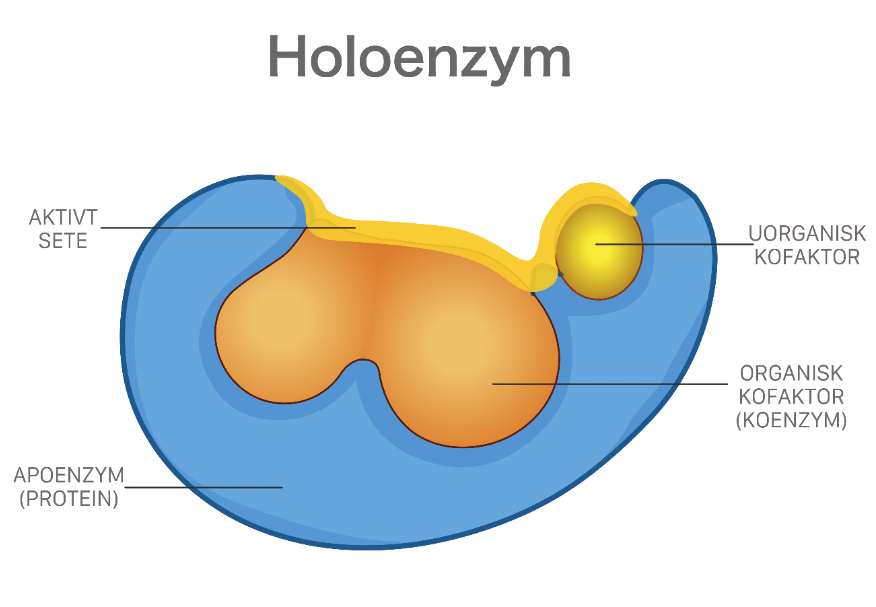
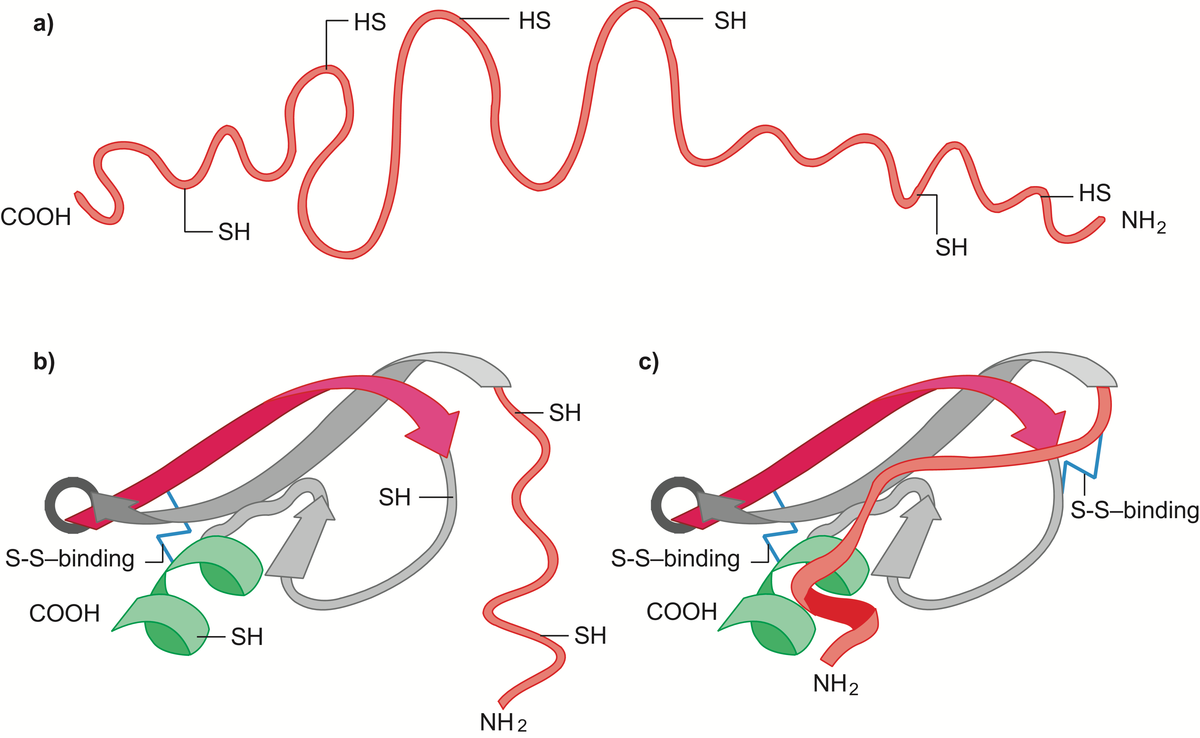
Enzymer er stoffer, hovedsakelig proteiner, som katalyserer de kjemiske prosessene i levende organismer. Enzymene fremmer de kjemiske reaksjonene uten at de selv forbrukes.
Det er enzymene som gjør det mulig for cellene å trekke energi ut av næringsmidlene, å lagre energi som fett og karbohydrat, og å bygge opp alle de bestanddeler som en levende celle består av, inkludert enzymene selv. Liv kan kjemisk sett sies å være resultatet av et kontrollert system av samarbeidende, enzymkatalyserte reaksjoner. Det er beskrevet vel 3000 forskjellige enzymer.
Ved siden av proteiner som fungerer som enzymer, eksisterer det også ribonukleinsyrer (RNA) som kan bidra til kjemisk katalyse. RNA-molekyler som virker som enzymer kalles ribozymer.
Noen eksempler på enzymer i menneskekroppen:
- Enzymet amylase finnes i spyttet og begynner fordøyelsen av mat allerede i munnen, ved å bryte ned stivelse fra for eksempel potet og brød til mindre bestanddeler.
- Enzymer bidrar til celledeling, blant annet gjennom prosessen der DNA replikeres. Enzymet helikase deler DNA-tråden på langs, og DNA-polymerase legger til nye nukleotider i tråden.


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.