Nervesystemet er en fellesbetegnelse på alt nervevev i kroppen. Nervesystemet styrer kroppens atferd gjennom å kontrollere muskler og kjertler (effektororganene), samt å motta og lede impulser fra omgivelsene gjennom sanseorganene.
Inndeling
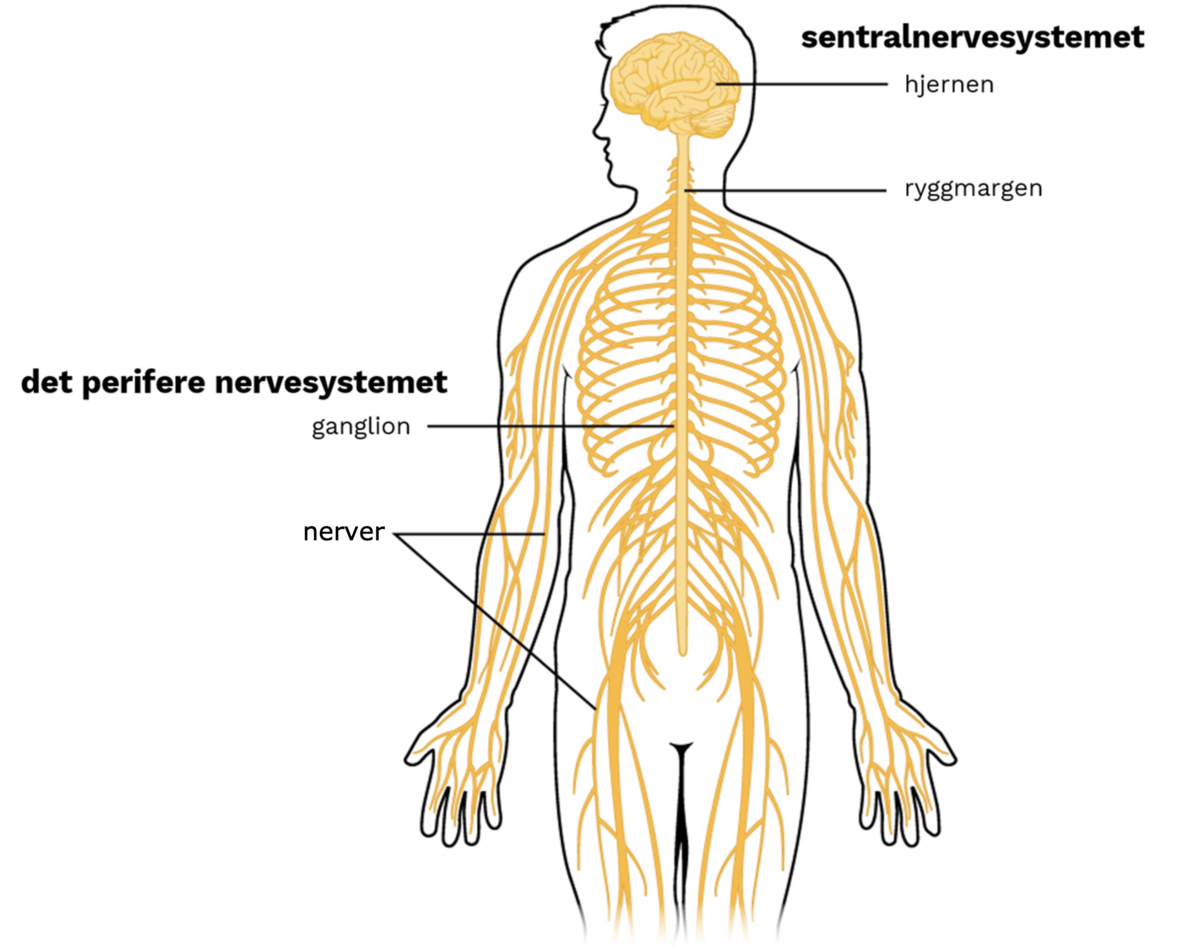
Nervesystemet deles anatomisk inn i sentralnervesystemet og det perifere nervesystemet, og funksjonelt deles det inn i det somatiske («kontrollerbare») og det autonome («automatiske») nervesystemet.
Sentralnervesystemet omfatter hjernen og ryggmargen. Det perifere nervesystemet utgjøres av nervene som løper ut fra ryggmargen (ryggmargsnervene) og fra hjernen (hjernenervene), samt nervecellene i tarmsystemet. Nervecellene i tarmsystemet kalles det enteriske nervesystem.
Det somatiske nervesystemet kontrollerer aktiviteten i skjelettmuskulaturen, altså de viljestyrte musklene. Det autonome nervesystemet styrer aktivitetene i de indre organene. Det finnes mange koblinger mellom systemene, slik at nervesystemet totalt sett opererer som én sammensatt enhet.
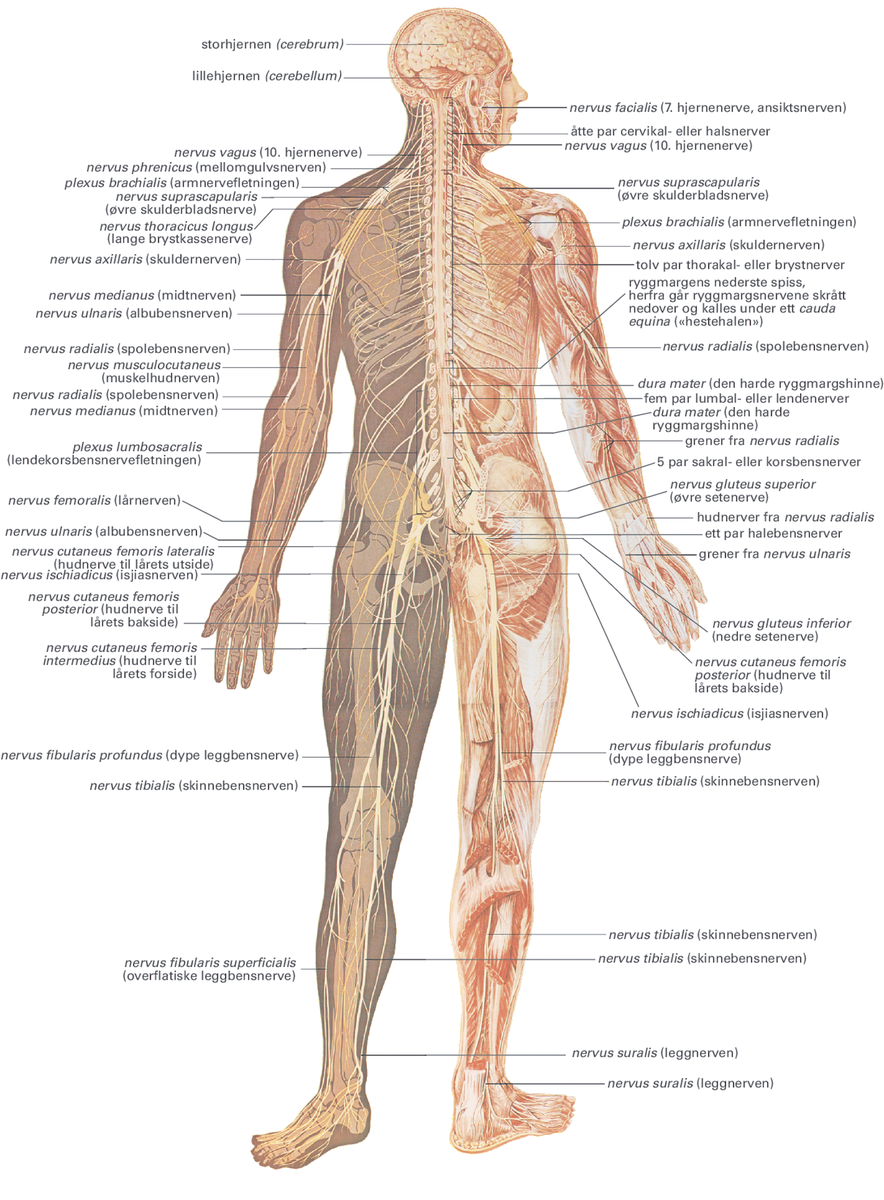
Figur av hele kroppens nervesystem. Alle de store nervene har et eget latinsk navn.
Nerveceller og gliaceller
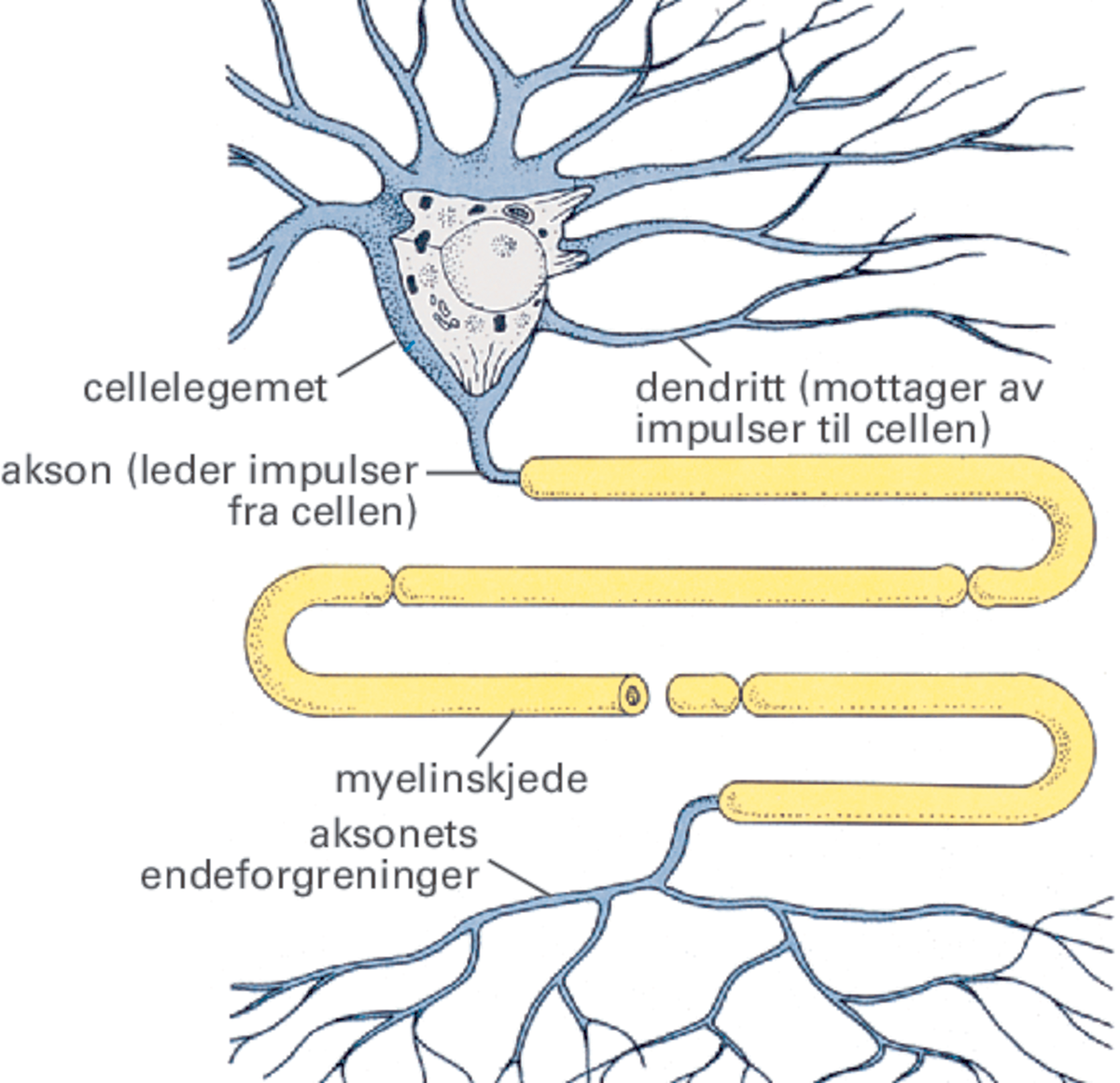
Nervesystemet. Til tross for at nervecellene har mange forskjellige former, består de alle av de samme grunnleggende komponentene. Essensielt er selve cellelegemet (perikaryon) med kjernen (nucleus) og diverse organeller som har betydning for cellens enkelte funksjoner, og lange utløpere som leder og overfører nerveimpulsene.
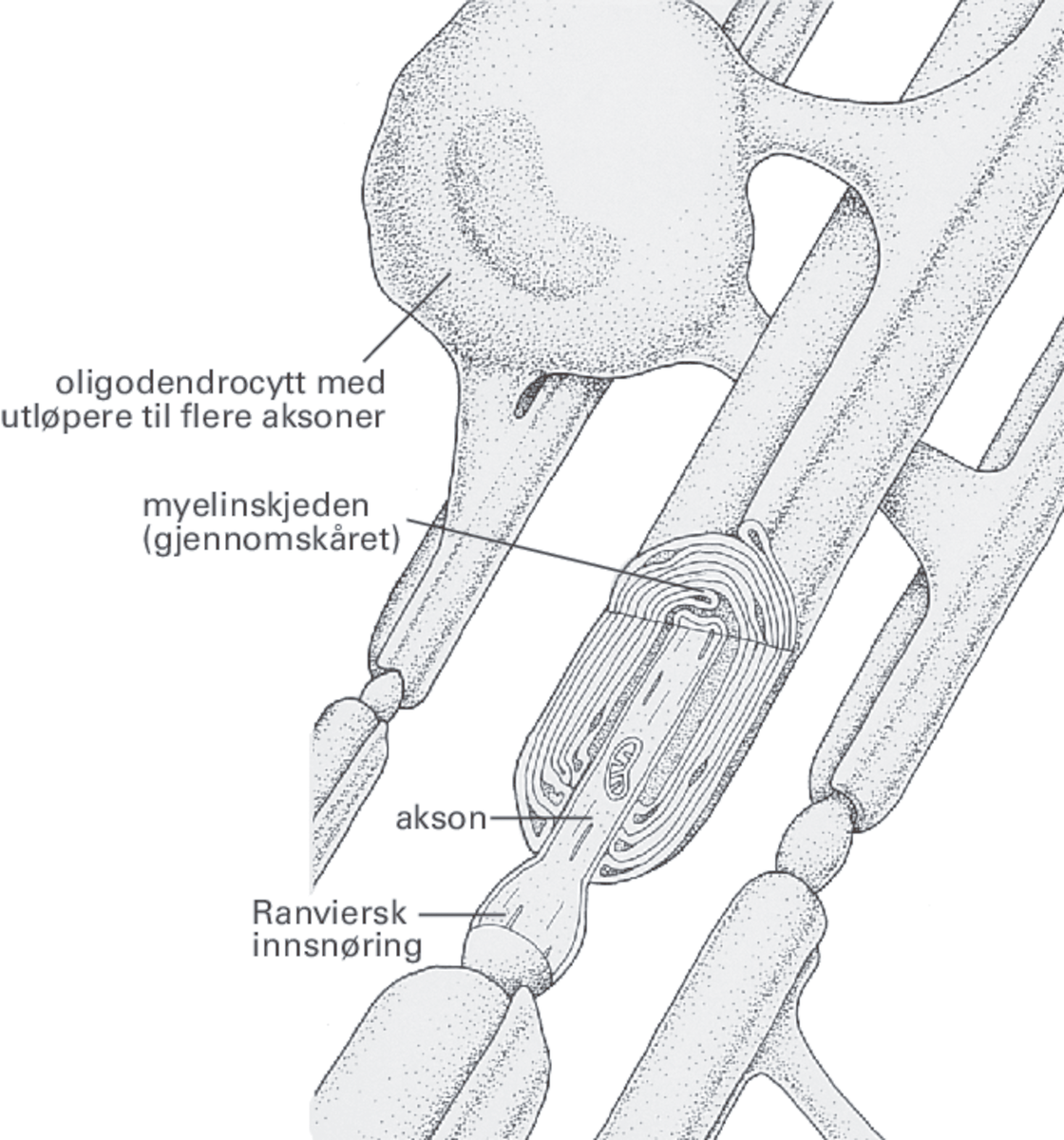
Hos noen nerver er aksonet kledd med et hylster av lagvise og konsentriske celler som inneholder myelin, et materiale som overveiende består av lipider. Det isolerer og beskytter aksonet. Dette hylsteret kalles myelinskjede og er dannet av såkalte oligodendroglia, som er en type gliacelle.
Nervesystemet er bygget opp av to ulike hovedtyper av celler: nerveceller og gliaceller (også kalt nevroglia). Nervecellene er de cellene som gir opphav til nerveimpulser og nervesignaler. Gliacellene virker som støtteceller til nervecellene. Forskning har imidlertid vist at gliacellene også kan gi kjemiske signaler som regulerer nervecellenes funksjoner (blant annet å øke ledningshastigheten), men de mangler evnen til å danne nerveimpulser. Det er om lag ti ganger så mange gliaceller som nerveceller.
Nervecellene varierer sterkt i størrelse og form. En nervecelle består av et cellelegeme (cellekropp, soma), hvor cellekjernen er, og et varierende antall utløpere. Utløperne virker som et veinett mellom de ulike nervecellene, slik at de kan kommunisere med hverandre ved nerveimpulser.
Utløperne er av to slag: dendritter og aksoner. Dendrittene er hovedsakelig mottakerapparat for innkommende signaler fra andre nerveceller, mens aksonene og deres forgreninger har til oppgave å formidle nervecellens signaler videre til neste celle i nettverket. Nervecellene selv blir dermed viktige knutepunkt for bearbeiding og videre utsending av signalene. Forgreningsmønsteret av utløperne varierer mye mellom ulike nerveceller. Celler som har samme funksjon, har gjennomgående samme forgreningsmønster.
Nerveimpulser
Nervecellene kommuniserer i hovedsak gjennom nerveimpulser. En nerveimpuls er et kortvarig elektrisk signal (aksjonspotensial) som skyldes en strøm av elektrisk ladede ioner (for eksempel natrium- eller kalsiumioner) gjennom spesielle kanaler i nervecellenes cellemembran.
Signalene kan formidles raskt i de tilfellene der dette er viktig. Mer tallrike og langsommere ledende aksoner muliggjør signalformidling av mindre presserende opplysninger over mange kanaler samtidig. Derved kan flere opplysninger formidles på bekostning av langsommere overføring. Nerveimpulsene er kortvarige slik at nye signaler kan sendes med korte intervaller. Derved blir frekvenskoding (hyppigheten av signaler i en bestemt fiber) en viktig faktor i formidlingen av opplysningene.
Hastigheten som nerveimpulsen (aksjonspotensialet) forflytter seg med er avhengig av to faktorer: aksonets diameter og aksonets myelinisering.
- Aksonets diameter. Tykke aksoner leder impulsene raskere enn tynne. Eksempelvis føler man selve kontakten mot kaldt metall raskere (tykke aksoner) enn man oppfatter at det er kaldt (tynne aksoner).
- Aksonets myelinisering. Aksonene kan være omgitt av et fettlag (myelin) laget av spesielle celler (Schwann-skjede). Myelinet ligger i regelmessige avsnitt rundt aksonet, med små myelinfrie mellomrom mellom avsnittene. Aksjonspotensialet kan på den måten «hoppe» fra mellomrom til mellomrom, slik at de myeliniserte aksonene blir raskere ledere enn umyeliniserte – opptil 100 meter per sekund mot bare noen få meter per sekund. Lokalbedøvelse virker forbigående ved å blokkere aksjonspotensialene langs aksonet. Skade på myelinskjeden kan føre til at impulsene ledes dårligere eller helt opphører (eksempelvis ved MS).
Hver enkelt impuls har samme styrke, uavhengig av den distansen som den ledes over, og signalene forplantes helt ut i alle endegrenene av aksonene. Dermed reduseres sjansen for å miste opplysninger på grunn av avstanden til mottakeren.
Synapser
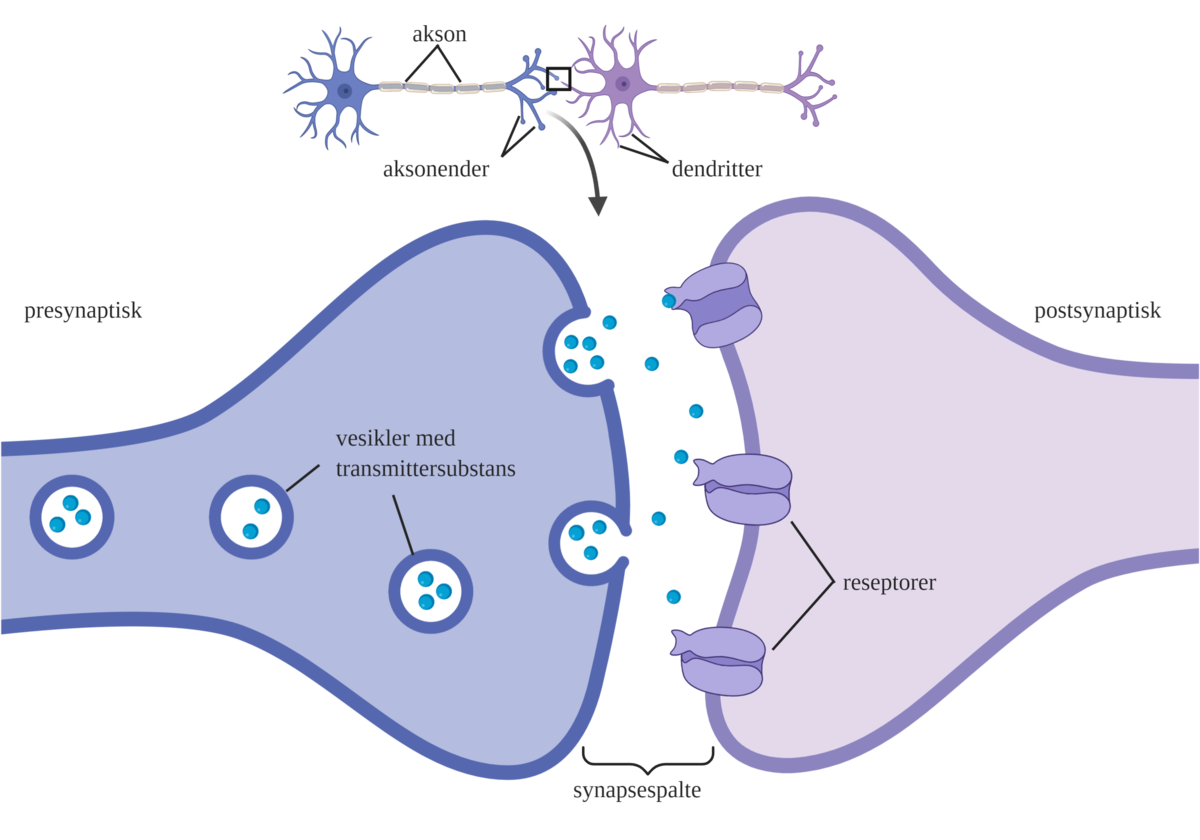
Aksonene deler seg oftest opp i mange grener. Hver gren ender opp i små knopper (terminaler, boutoner) som ligger i nær kontakt med andre målceller, vanligvis med deres dendrittutløpere. De spesialiserte kontaktområdene mellom et akson og en dendrittutløper kalles synapser, og deres oppgave er å formidle signaloverføringen mellom nervecellene.
Aksongrenenes ender inneholder små blærer (vesikler) som inneholder bestemte signalstoffer (transmittersubstanser). Denne delen av synapsen kalles presynaptisk. Når en nerveimpuls når frem til aksonenden, frigjøres transmittersubstansen i den smale synapsespalten. Transmittersubstansen får derved mulighet til å binde seg til spesielle mottakerapparater (reseptorer) på mottakercellen. Mottakercellen kalles postsynaptisk. Signalene går altså fra presynaptisk til postsynaptisk.
Når transmittersubstansen binder seg til reseptorene, åpnes ionekanaler i cellemembranen til den postsynaptiske cellen. Strømmen av ioner gjennom ionekanalen fører til forandring av konsentrasjonen av ioner på innsiden og utsiden av cellen. Denne konsentrasjonsforskjellen er vanligvis nøye avstemt og kalles membranpotensialet. Når membranpotensialet endres oppstår det et signal som kan ledes videre til neste nervecelle. Alle prosessene som skjer over synapsen foregår svært raskt, og det hele er oftest gjennomført i løpet av brøkdeler av et sekund.
Aktiverende og hemmende effekter
Signaloverføringen i synapsen kan føre til at den postsynaptiske cellen blir aktivert (eksitert) eller hemmet (inhibert). Den første typen bidrar til å aktivere den postsynaptiske cellen fordi transmitter-/reseptorbindingen fører til en innadrettet (depolariserende) Na+-strøm i den postsynaptiske cellen. Hvis effekten er tilstrekkelig sterk, vil det utløse en impuls i mottakercellen (en aktiviserende, eksitatorisk synaptisk effekt).
Den andre hovedtypen av postsynaptiske effekter fører til en økning av membranpotensialet i den postsynaptiske cellen (hyperpolarisering). Derved reduseres sannsynligheten for aktivering av den postsynaptiske cellen (hemmende, inhibitorisk synaptisk effekt). Slike inhibitoriske effekter kommer oftest i stand ved at transmittersubstansen som frigjøres ved slike synapser, binder seg til reseptorer med ionekanaler som gir opphav til en strøm av Cl--ioner inn i den postsynaptiske cellen eller en strøm av K+-ioner ut av cellen.
Transmittersubstanser
En rekke ulike stoffer benyttes som transmittersubstanser i nervesystemet. Hver type nervecelle benytter samme transmittersubstans, og i mange tilfeller vil flere transmittersubstanser benyttes av samme nervecelle.
Noen av de aktuelle transmittersubstansene har vanligvis eksitatoriske synaptiske effekter, andre har vanligvis inhibitoriske effekter. Noen kan ha den ene typen av effekt på noen målceller og den motsatte effekten på andre. Den utslagsgivende faktor er hvilken type ionekanal eller G-proteinmediert effekt de postsynaptiske reseptorene er koblet til.
Kjennskapet til de ulike transmittersubstansene og deres reseptorer har stor praktisk interesse. Innsikt i disse stoffenes kjemiske egenskaper har gjort det mulig å fremstille medikamenter som øker eller hemmer synaptiske effekter i begrensede deler av nervesystemet.
Utvikling
Anlegget til nervesystemet er etablert allerede på et meget tidlig trinn i fosterutviklingen. Under utviklingen dannes anleggene for det modne nervesystemet ved et komplisert samspill av celledeling (proliferasjon), cellevandringer (migrasjon), celledød, utvekst av processer og dannelse av nervebaner. Ved fødselen har de aller fleste potensielle nerveceller gjennomgått sin siste celledeling. De fleste større nervebaner og deres makrokoblinger til sine målceller er etablert. Disse prosessene under fosterutviklingen er i hovedsak styrt av et arvemessig bestemt utviklingsprogram, utgått fra det ektodermale kimblad.
Erfaringsbaserte forandringer i nervesystemet
Etter fødselen opplever barnet i tillegg påvirkninger fra og interaksjon med sine omgivelser. Disse påvirkningene spiller en utslagsgivende rolle for den videre utviklingen av nervesystemet. Lignende effekter er mest dramatisk påvist hos barn som har defekt syn på grunn av linsefordunklinger i øynene. Hvis linsedefektene repareres først i voksen alder, er pasientene i første omgang funksjonelt blinde, og de har en langvarig og ofte frustrerende treningsperiode for å «lære» synsområdene i hjernen hva signalene fra øyet betyr. Tilsvarende kan man se at små barn kan «glemme» å gå hvis de blir liggende ubevegelige i en lengre periode, og de kan trenge relativt lang tid for å reetablere gangfunksjonen.
Slike eksempler viser at det tidlige nervesystemet normalt er avhengig av vedvarende interaksjon med omgivelsene og kontinuerlig trening for å utvikle sin fulle funksjonelle kapasitet. Disse trenings- og opplæringseffektene kalles ofte for plastiske forandringer i nervesystemet. De er mest dramatiske i barneårene, og det er vist i dyreforsøk at slike plastiske forandringer er ledsaget av forandringer i det synaptiske koblingsmønsteret på mikronivå i de aktuelle hjerneområdene. I det hele er disse plastiske effektene i utviklingen av hjernen en meget håndgripelig begrunnelse for å la barn vokse opp i stimulerende og positivt utfordrende miljø.
Plastiske egenskaper hos voksne
Plastiske egenskaper er fortsatt til stede også i det voksne nervesystemet, om enn vanligvis i avtagende grad.
I enkelte områder kan vedvarende synaptisk aktivering av nerveceller føre til mer langvarige endringer i den synaptiske effektiviteten i de aktiverte synapsene. Slike forandringer skyldes i første omgang biokjemiske endringer i det synaptiske maskineriet. Ofte er det spørsmål om binding av fosfatgrupper til reseptormolekyler eller endringer i mengden av transmittersubstans som frigjøres i de aktiverte synapsene. I noen tilfeller er det også påvist at man kan få aktivitetsavhengige endringer i mikrokoblingsmønsteret i bestemte nervebaner, blant annet ved vekst og mangfoldiggjøring av synapser. Det er i dag en vanlig oppfatning at denne typen av vedvarende endringer i synaptisk effektivitet kan være grunnlaget for lærings- og hukommelsesfunksjonene i nervesystemet.
Skader
I motsetning til mange av vevene i organismen, har nervesystemet begrenset evne til å reparere defekter etter skadelige påvirkninger. Hos høyerestående dyr finnes det få stamceller i hjernen som kan dele seg og danne nye nerveceller etter fødselen.
Nerveceller som er tapt etter sykdom eller skade, kan derfor kun i meget begrenset grad erstattes sammenlignet med mange andre vevstyper slik som hud eller beinvev. Slike skader etterlater seg derfor større eller mindre defekter, avhengig av skadens lokalisasjon og utstrekning. I mange tilfeller vil imidlertid de påvisbare defektene reduseres, til dels betydelig, i tiden etter den akutte skaden. Dette skyldes de plastiske egenskapene av nervesystemet. I ganske stor grad kan mikrokoblingsmønsteret i området omkring skaden forandres og derved overta noen av de tapte funksjonene. I andre tilfeller kan funksjonelt beslektede områder kompensatorisk redusere det funksjonelle tapet. Under alle omstendigheter er tydeligvis systematiske treningsopplegg og høy motivasjon vesentlige faktorer for bedring.
Avbrutte nervebaner
Noen skader i nervesystemet fører til avbrytelse av lange nervebaner. Den distale delen av aksonene, som mister kontakten med sitt cellelegeme, vil da degenerere i løpet av noen dager. Slike skadede aksoner i perifere nerver har imidlertid evnen til å regenerere den distale enden og gjenopprette funksjonell kontakt med målorganet. I de gunstigste tilfellene kan restitusjonen være perfekt. I andre tilfeller, avhengig av situasjonen på skadestedet, er utsiktene mye dårligere, men kan noen ganger bedres med transplantater av nervesegmenter og plastisk kirurgi. Avbrutte nervebaner i sentralnervesystemet, for eksempel i ryggmargen, har imidlertid ikke evnen til å regenerere de distale endene av skadede aksoner, og fører derfor oftest til permanente funksjonelle utfall. Muligheter for å stimulere aksonregenerasjon etter skader av sentrale nervebaner er i dag et meget aktivt forskningsfelt.
Det er nå klart at hovedgrunnen til manglende vekst av skadede aksoner i sentralnervesystemet er tilstedeværelse av hemmende proteiner i margskjedene (myelin) som omgir aksonene. En mulig fremtidig behandling av slike skader går derfor ut på å fjerne eller undertrykke disse hemmende proteinene distalt for skaden.
Les mer i Store norske leksikon
-
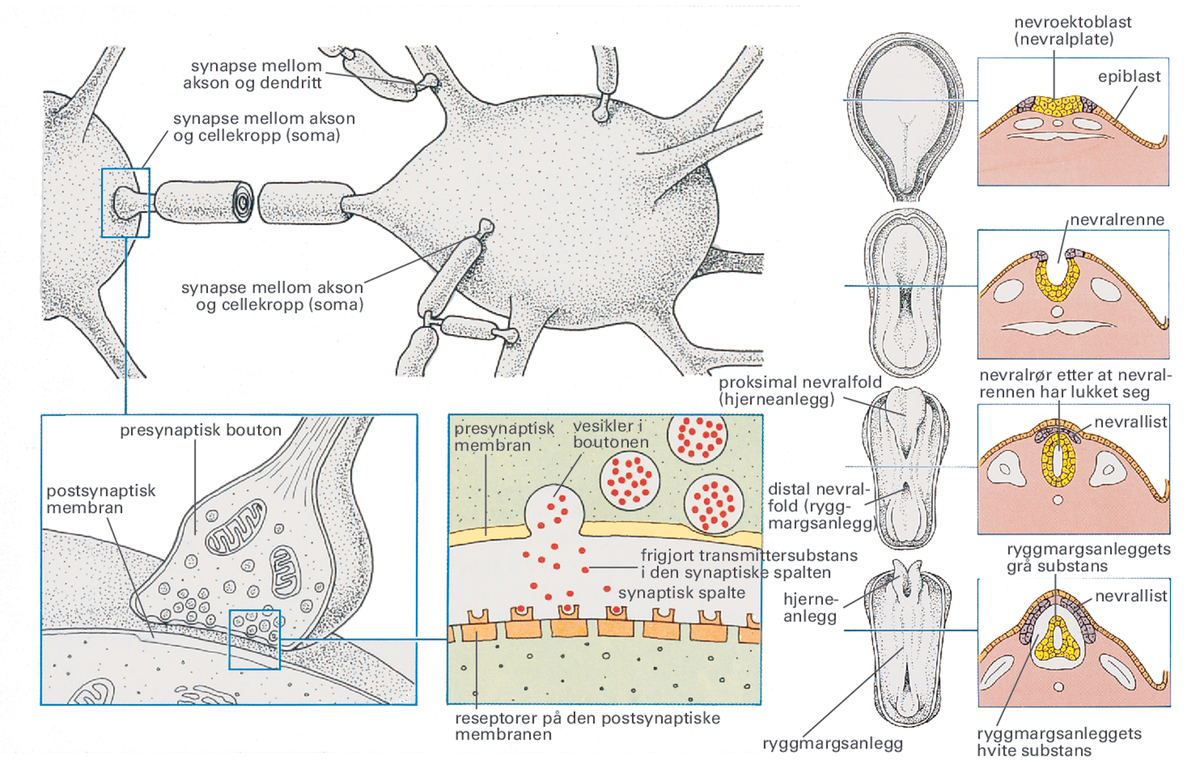
Nervesystemet. Til venstre: Synaptiske forbindelser mellom nerveceller (skjematisk). — Til høyre. Skjematisk fremstilling av utviklingen av nervesystemet i løpet av 3.–4. embryonaluke, sett ovenfra og i tverrsnitt.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.